题目内容
18.(1)在氮的单质和化合物中,遇到HCl会产生白烟的是B;气体颜色呈红色的是C.(用字母填空)A、氮气B、氨气C、二氧化氮 D、一氧化氮
(2)工业上常用氨氧化法生产硝酸,其过程包括氨的催化氧化(催化剂为铂铑合金丝网)、一氧化氮的氧化和水吸收二氧化氮生成硝酸.请回答下列问题:
①氨催化氧化的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O:
②水吸收二氧化氮生成硝酸的化学方程式为3NO2+H2O=2HNO3+NO,
(3)已知氨气(NH3)是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水.在实验室中通常用加热固体氯化铵和氢氧化钙的混合物来制取氨气.试回答下列问题:
①试写出实验室制取氨气的化学反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑
②收集氨气的方法是向下排空气法.
③如何检验收集的气体是氨气?试写出方法和结论:用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则证明为氨气;或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则证明是氨气.
分析 (1)氮气、氨气、二氧化氮、一氧化氮中,氨气和氯化氢相遇会产生白烟;二氧化氮气体颜色呈红色;
(2)①在一定条件下氨气与氧气反应生成一氧化氮和水;
②二氧化氮被水吸收生成硝酸和一氧化氮;
(3)①实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
②氨气的密度比空气小,所以用向下排空气法收集;
③氨气为碱性气体,与水反应生成NH3•H2O,电离出OH-离子,溶液呈碱性,可以利用湿润的红色石蕊试纸检验,也可以利用氨气和氯化氢气体相遇生成白烟设计实验.
解答 解:(1)氨气和氯化氢相遇会产生白烟;二氧化氮气体颜色呈红色,故答案为:B; C;
(2)①氨催化氧化的产物是一氧化氮和水,是工业生产硝酸获得一氧化氮的一步反应,化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
②水吸收二氧化氮生成硝酸的反应为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
(3)①实验室用氢氧化钙和氯化铵在加热条件下制备氨气,反应方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
②氨气的密度比空气小,所以用向下排空气法收集,故答案为:下;
③氨气为碱性气体,与水反应生成NH3•H2O,电离出OH-离子,溶液呈碱性,检验时可用用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则证明为氨气,或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则证明是氨气氨气;
故答案为:用蘸有浓盐酸的玻璃棒靠近试管口,如果产生白烟,则证明为氨气;或用湿润的红色石蕊试纸靠近试管口,如果试纸变蓝,则证明是氨气;
点评 本题考查氮的氧化物和氢化物的实验探究,题目难度中等,注意实验室制备氨气的所用药品,氨气的检验方法.

 阅读快车系列答案
阅读快车系列答案| A. | X元素的氢化物的水溶液显碱性 | |
| B. | Z元素的离子半径大于W元素的离子半径 | |
| C. | Z元素的单质在一定条件下能与X元素的单质反应 | |
| D. | Y元素的氧化物是含有极性键的非极性分子 |
| A. | 在元素周期表里,主族元素所在的族序数等于原子核外电子数 | |
| B. | 在元素周期表里,元素所在的周期序数等于原子核外电子层数 | |
| C. | 最外层电子数为8的粒子是稀有气体元素的原子 | |
| D. | 元素的原子序数越大,其原子半径也越大 |
| A. | 1:0.45 | B. | 1:1 | C. | 1:0.29 | D. | 4.5:2.9 |
| A. | 醋酸的电离:CH3COOH?CH3COO-+H+ | |
| B. | 纯水中水的电离:2H2O?H3O++OH- | |
| C. | 氢硫酸的电离:H2S?2H++S2- | |
| D. | 氯化铁和硫氰化钾反应:Fe3++3SCN-?Fe(SCN)3 |
| A. | a+b<c+d,Q>0 | B. | a+b>c+d,Q>0 | C. | a+b<c+d,Q<0 | D. | a+b=c+d,Q>0 |
| A. | 用淀粉溶液检验溶液中是否存在碘单质 | |
| B. | 用激光笔照射稀豆浆,有丁达尔效应,稀豆浆属于胶体 | |
| C. | 用盐酸溶液鉴别碳酸钠溶液与硫酸钠溶液 | |
| D. | 用分液漏斗分离水与乙醇的混合物 |
 △H=+88.6kJ•mol-1则M、N相比,较稳定的是M.
△H=+88.6kJ•mol-1则M、N相比,较稳定的是M.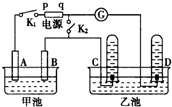 在图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题:
在图均用石墨作电极的电解池中,甲池中为500mL含某一溶质的蓝色溶液,乙池中为500mL稀硫酸,闭合K1,断开K2进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题: