题目内容
下列比较或归纳正确的是( )
| A、稳定性:NH3<PH3<ASH3 |
| B、离子半径:Cl->S2->Al3+ |
| C、酸性:HClO4>H2SO4>H3PO4 |
| D、碱性:Be(OH)2>Mg(OH)2>Al(OH)3 |
考点:非金属在元素周期表中的位置及其性质递变的规律,同一主族内元素性质递变规律与原子结构的关系
专题:元素周期律与元素周期表专题
分析:A.非金属性越强,气态氢化物越稳定;
B.电子层越多,离子半径越大;具有相同排布的离子,原子序数大的离子半径小;
C.非金属性越强,最高价氧化物的水化物酸性越强;
D.金属性越强,最高价氧化物的水化物碱性越强.
B.电子层越多,离子半径越大;具有相同排布的离子,原子序数大的离子半径小;
C.非金属性越强,最高价氧化物的水化物酸性越强;
D.金属性越强,最高价氧化物的水化物碱性越强.
解答:
解:A.非金属性N>P>As,气态氢化物的稳定性为NH3>PH3>ASH3,故A错误;
B.电子层越多,离子半径越大;具有相同排布的离子,原子序数大的离子半径小,则离子半径为S2->Cl->Al3+,故B错误;
C.非金属性Cl>S>P,最高价氧化物的水化物酸性为HClO4>H2SO4>H3PO4,故C正确;
D.金属性Mg的最强,最高价氧化物的水化物碱性为Mg(OH)2>Al(OH)3,Mg(OH)2>Be(OH)2,故D错误;
故选C.
B.电子层越多,离子半径越大;具有相同排布的离子,原子序数大的离子半径小,则离子半径为S2->Cl->Al3+,故B错误;
C.非金属性Cl>S>P,最高价氧化物的水化物酸性为HClO4>H2SO4>H3PO4,故C正确;
D.金属性Mg的最强,最高价氧化物的水化物碱性为Mg(OH)2>Al(OH)3,Mg(OH)2>Be(OH)2,故D错误;
故选C.
点评:本题考查元素性质及比较,为高频考点,把握同周期、同主族元素性质的变化规律为解答的关键,注重规律性知识的归纳及应用的考查,题目难度不大.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
下列说法正确的是( )
| A、食品保鲜膜成分为聚氯乙烯 |
| B、甲醛可作为海产品的防腐剂 |
| C、盐析可提纯蛋白质并保持其生理活性 |
| D、医疗上用于消毒的酒精其体积分数为95% |
现有X、Y、Z、W、Q五种短周期元素,原子序数依次增大,Y、Z、W、Q形成的简单离子具有相同的电子层结构,YX3、X2Z、X2Z2、W2Z、W2Z2都是常见的化合物,其中,YX3在常温下呈气态,能使酚酞溶液变红色.下列有关推断正确的是( )
| A、简单离子半径:Y>Z>W>Q>X |
| B、W2Z2与X2Z反应中氧化剂与还原剂物质的量之比为1:2 |
| C、X能分别与Y、Z、W形成共价化合物 |
| D、Y、W、Q的最高价氧化物对应的水化物两两之间一定相互反应 |
正确掌握化学用语是学好化学的基础,下列有关表述正确的是( )
| A、H、D、T互为同素异形体 |
| B、氨分子中的化学键为非极性共价键 |
C、NH4Cl的电子式: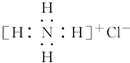 |
D、S2-的结构示意图: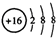 |
下列关于有机物的说法中不正确的是( )
| A、乙醇和乙酸均可以使酸性高锰酸钾溶液褪色 |
| B、淀粉、油脂、蛋白质在一定条件下都能发生水解反应 |
| C、正丁烷比异丁烷的沸点高 |
| D、乙醇和乙酸均能与金属钠能反应 |
下列物质中既含有离子键又含有共价键的化合物是( )
| A、NaCl |
| B、CH4 |
| C、KOH |
| D、CH3Cl |
下列叙述正确的是(设NA为阿伏加德罗常数的数值)( )
| A、检验溶液中是否含有Fe2+的方法是先滴加氯水,再滴加KSCN溶液 |
| B、铅蓄电池放电时的负极反应式为:Pb02+4H2SO4+2e-═PbSO4+2H2O |
| C、Na2CO3溶液加水稀释后,恢复至原温度,溶液的pH和Kw均减小 |
| D、某电池的总反应为:5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,每生成1mol Na2Mn5O10转移电子数2NA |
推理是研究和学习化学的一种重要方法.以下推理正确的是( )
| A、酸碱发生中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 |
| B、碱中都含有氢氧根,所以碱中一定含有氢元素 |
| C、酸能使紫色石蕊溶液变红,CO2通入紫色石蕊溶液后溶液变红,所以CO2是酸 |
| D、有机物都含碳元素,所以含碳元素的化合物都是有机物 |
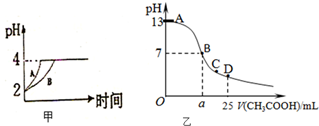 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: