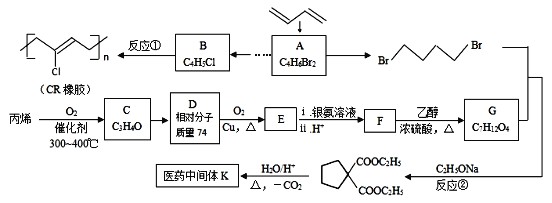
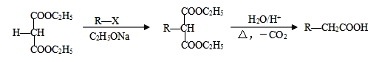题目内容
【题目】某校学生课外活动小组为测定钠元素的相对原子质量,设计的装置如图所示,该装置(包括水和干燥剂)的总质量为ag,从实验室取出bg(不足量)钠放入水中,塞紧瓶塞,完全反应后再称量此装置的总质量为cg。试回答:

(1)实验室取用一小块钠,需要用到__________________实验仪器。
(2)此干燥管的作用是________________________;若此钠块有极少量被氧化,则测出的相对原子质量会比实际相对原子质量________(填“偏大”、“偏小”或“不变”)。
(3)有甲同学建议在图中干燥管上再连一同样干燥管,其目的是____________________,计算钠的相对原子质量的表达式为____________________。
(4)有乙同学为避免由于行动不够迅速产生偏差,又建议在集气瓶中再加入一定量煤油,其目的是_____。
【答案】滤纸、小刀、镊子、玻璃片 吸收水蒸气,避免集气瓶中水蒸气逸出 偏大 避免空气中水蒸气被干燥剂吸收 b/(a+b—c) 避免钠投入后,立即与水反应,来不及塞上塞子
【解析】
(1)取用金属钠时,用镊子夹取一小块金属钠,用滤纸吸收煤油或石蜡,在玻璃片或滤纸上用小刀切黄豆大小的金属钠,投入水中,用玻璃片覆盖水槽,防止液体溅出,所以所需用品至少有:小刀、镊子、滤纸、玻璃片,故答案为:刀、镊子、滤纸、玻璃片;
(2)无水氯化钙吸收容易吸收水蒸气,装置中的干燥管是用来吸收水蒸气,避免集气瓶中水蒸气逸出;若钠块有极少量被氧化,会导致生成的氢气减少,即(a+b-c)减小,结合(3)中的表达式,测出的相对原子质量会比实际相对原子质量偏大,故答案为:吸收水蒸气,避免集气瓶中水蒸气逸出;偏大;
(3)空气的水蒸气容易被无水氯化钙吸收,影响了氢气质量的计算,所以应该在干燥管上再连接一同样的干燥管,目的是避免空气中水蒸气被干燥剂吸收;依题设实验数据,bg钠与足量水反应产生氢气的质量为(a+b-c)g,设所求钠的相对原子质量为x,根据电子守恒可得:![]() =
=![]() ×2,解得:x=
×2,解得:x=![]() ,故答案为:避免空气中水蒸气被干燥剂吸收;
,故答案为:避免空气中水蒸气被干燥剂吸收; ![]() ;
;
(4)钠与水的反应比较剧烈,为了避免钠投入后,立即与水反应,来不及塞上塞子,影响氢气质量的测定,需要在集气瓶中再加入一定量的石蜡油或煤油,故答案为:避免钠投入后,立即与水反应,来不及塞上塞子。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是_______,说明氧化性Ag+>Cu2+。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
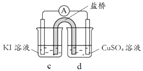
实验 | 试剂 | 编号及现象 | |
试管 | 滴管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
① 经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
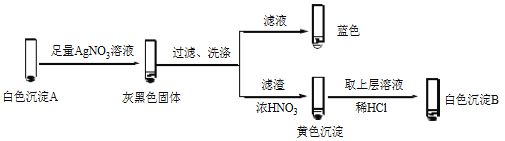
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是____,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
|
|
|
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极 上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是_______(用电极反应式表示)。
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_______。
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:_______。
(资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108)