题目内容
【题目】能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)已知H2(g)、CO(g)和CH3OH(l )的燃烧热△H分别为285.8kJ·mol1、283.0kJ·mol1和726.5kJ·mol1。请回答下列问题:
①写出表示H2燃烧热的热化学反应方程式____________________。
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_________________。
(2)以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ.CH4(g)+H2O(g)= CO(g)+3H2(g) △H=+206.0kJ/mol
Ⅱ.CO(g)+2H2(g)= CH3OH(g) △H=-129.0kJ/mol
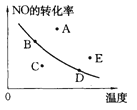
①将2.0mol CH4和1.0mol H2O(g)通入容积为2L的反应容器,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如图。在100℃时达到平衡所需的时间为5min,则用CO表示该反应的平均反应速率为_________________。100℃时反应Ⅰ的平衡常数为_________________。

②工业上利用甲醇制备氢气的常用方法有甲醇蒸气重整法。该法中的一个主要反应为CH3OH(g) ![]() CO(g)+2H2(g),请描述在其他条件不变时,温度对甲醇转化率的影响:____________________。
CO(g)+2H2(g),请描述在其他条件不变时,温度对甲醇转化率的影响:____________________。
【答案】![]() ΔH=-285.8
ΔH=-285.8![]()
![]() ΔH=-443.5
ΔH=-443.5![]() 0.08mol/L/min 11.52 升高温度,甲醇转化率升高
0.08mol/L/min 11.52 升高温度,甲醇转化率升高
【解析】
(1)①燃烧热指在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,所以H2燃烧热的热化学反应方程式为![]() ΔH=-285.8 kJ/mol;
ΔH=-285.8 kJ/mol;
②由CO(g)和CH3OH(l)的燃烧热可得热化学方程式:
①CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJmol-1
O2(g)=CO2(g) △H=-283.0kJmol-1
②CH3OH(l)+![]() O2(g)=CO2(g)+2 H2O(l) △H=-726.5kJmol-1
O2(g)=CO2(g)+2 H2O(l) △H=-726.5kJmol-1
根据盖斯定律,②-①可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l),该反应的反应热△H=-726.5kJmol-1-(-283.0kJmol-1)=-443.5kJmol-1,故热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l) △H=-443.5kJmol-1;
(2)①将2.0molCH4和1.0mol H2O(g)通入容积为2L的反应容器,则初始c(CH4)=1mol/L,c(H2O)=0.5mol;100℃时达到平衡时甲烷的转化率为40%,所以消耗甲烷c(CH4)=0.4mol/L,则剩余c(CH4)=0.6mol/L,根据方程式可知消耗c(H2O)=0.4mol/L,则剩余c(H2O)=0.1 mol/L,生成的c(CO)=0.4mol/L,c(H2)=1.2mol/L;CO表示该反应的平均反应速率为v(CO)=![]() ;根据平衡常数定义可知K=
;根据平衡常数定义可知K=![]() ;
;
②根据反应CO(g)+2H2(g)= CH3OH(g) ΔH=-129.0kJ/mol可知CH3OH(g) ![]() CO(g)+2H2(g) ΔH>0,即该反应正反应为吸热反应,所以其他条件不变时,温度越高,甲醇的转化率越大。
CO(g)+2H2(g) ΔH>0,即该反应正反应为吸热反应,所以其他条件不变时,温度越高,甲醇的转化率越大。

【题目】某研究小组将纯净的SO2气体通入0.1molL﹣1的Ba(NO3)2溶液中,得到了BaSO4沉淀。为探究上述溶液中何种微粒能氧化通入的SO2,该小组提出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2;
(1)验证假设一
该小组设计实验验证了假设一,请在下表空白处填写相关实验现象.
实验步骤 | 实验现象 | 结论 |
实验1:在盛有不含O2的25mL0.1molL﹣1BaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | _______ | 假设一成立 |
实验2:在盛有不含O2的25mL0.1molL﹣1Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 | ________ |
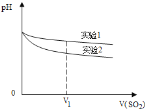
为深入研究该反应,该小组还测得上述两个实验中溶液pH随通入SO2体积的变化曲线如图。实验1中溶液pH变小的原因是____________;V1时,实验2中溶液pH小于实验1的原因是__________。(用离子方程式表示)
(2)验证假设二
请设计实验验证假设二,写出实验步骤、预期现象和结论:
实验步骤 | 实验现象 | 结论 |
__________________ | ______________ | 假设二成立 |
(3)若假设二成立,请预测:在相同条件下,分别用足量的O2和KNO3氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反应后两溶液的pH前者_____________(填“大于”或“小于”)后者,理由是__________________________。