题目内容
【题目】化学与生活密切相关。
I. K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH![]() Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(1)基态Cr 原子的价电子轨道表达式为_________________。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为___________,碳原子的轨道杂化类型为_________,所含σ键与π键的数目之比为______________________。
(3)已知Cr3+等过渡元素水合离子的颜色如下表所示:
离子 | Se3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Se3+、Zn2+的水合离子为无色的原因为_______________________。
II. ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。
(4) Fe[Zn(OH)Cl2]2溶液中不存在的微粒间作用力有________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
溶液中[Zn(OH)Cl2]-的结构式为_____________________。
III.锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。

(5)锌的堆积方式为_________,配位数为__________________。
(6)若梓原子的半径为a pm,阿伏加德罗常数的值为NA,则锌晶体的密度为______g/㎝3 (用含a的代数式表示)。
【答案】 ![]() O>C>H sp3和sp2 7:1 3d轨道上没有未成对电子(3d轨道上电子为全空或全满) AC
O>C>H sp3和sp2 7:1 3d轨道上没有未成对电子(3d轨道上电子为全空或全满) AC  或
或 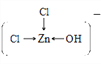 六方最密堆积 12
六方最密堆积 12 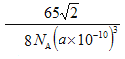 或
或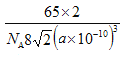
【解析】(1)基态Cr 原子的核外电子数是24,价电子轨道表达式为![]() 。(2) 非金属性越强,电负性越大,则CH3COOH分子中所含元素的电负性由大到小的顺序为O>C>H。其中饱和碳原子形成sp3杂化,羧基中碳原子的轨道杂化类型为sp2。单键都是σ键,双键中含有1个σ键和1个π键,因此所含σ键与π键的数目之比为7:1。(3)根据离子的核外电子排布可判断由于d轨道上没有未成对电子(3d轨道上电子为全空或全满),所以Se3+、Zn2+的水合离子为无色。(4) Fe[Zn(OH)Cl2]2溶液中以阴阳离子的形式存在,存在的微粒间作用力有共价键、配位键、范德华力和氢键,不存在离子键和金属键,答案选AC;[Zn(OH)Cl2]-中Zn提供空轨道,氯原子和氧原子提供孤对电子,所以溶液中[Zn(OH)Cl2]-的结构式为
。(2) 非金属性越强,电负性越大,则CH3COOH分子中所含元素的电负性由大到小的顺序为O>C>H。其中饱和碳原子形成sp3杂化,羧基中碳原子的轨道杂化类型为sp2。单键都是σ键,双键中含有1个σ键和1个π键,因此所含σ键与π键的数目之比为7:1。(3)根据离子的核外电子排布可判断由于d轨道上没有未成对电子(3d轨道上电子为全空或全满),所以Se3+、Zn2+的水合离子为无色。(4) Fe[Zn(OH)Cl2]2溶液中以阴阳离子的形式存在,存在的微粒间作用力有共价键、配位键、范德华力和氢键,不存在离子键和金属键,答案选AC;[Zn(OH)Cl2]-中Zn提供空轨道,氯原子和氧原子提供孤对电子,所以溶液中[Zn(OH)Cl2]-的结构式为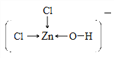 或
或 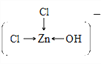 。(5)根据晶胞结构可知锌的堆积方式为六方最密堆积,配位数为12。(6).晶胞上下面的边长是2apm,面积是
。(5)根据晶胞结构可知锌的堆积方式为六方最密堆积,配位数为12。(6).晶胞上下面的边长是2apm,面积是![]() ,晶胞的高是
,晶胞的高是![]() ,体积是
,体积是![]() ,所以晶胞的密度是
,所以晶胞的密度是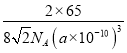 。
。

【题目】下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 在密闭容器中有反应:A+xB(g) | A非气体、x=1 |
C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
D | 向5mL 0.005mol·L-1 FeCl3溶液中加入5mL 0.015mol·L-1 KSCN溶液,溶液呈红色,再滴加几滴1 mol·L-1 KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
A. A B. B C. C D. D


