题目内容
某学生用邻苯二甲酸氢钾![]() ,式量为204.0)测定NaOH溶液的浓度,若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表!
,式量为204.0)测定NaOH溶液的浓度,若每次都精确取用邻苯二甲酸氢钾为0.2040g.滴定终点时溶液的pH约为9.1(pH计测量),滴定时用酚酞做指示剂,用待测NaOH溶液滴定邻苯二甲酸氢钾,该生进行三次实验,每次消耗氢氧化钠溶液的体积如下表!
| 实验编号 | 邻苯二甲酸氢钾质量(g) | 待测NaOH溶液体积(mL) |
| l | 0.2040 | 23.20 |
| 2 | 0.2040 | 19.95 |
| 3 | 0.2040 | 20.05 |
(1)计算NaOH溶液的物质的量浓度
(2)该学生测定出来的NaOH溶液的物质的量浓度高于其实际值,造成该结果的原因可能是_________.
A.盛放邻苯二甲酸氢钾的锥形瓶未用待装液润洗
B.读消耗NaOH溶液的体积时,滴定前仰视,滴定后俯视
C.滴速太快没来得及观察就已经变色
D.配制NaOH溶液时,NaOH固体中可能混有KOH
(1)0.05000mol/L;(2)B
解析:
【分析预测及备考建议】实验数据的处理和实验中的误差分析是学生应该具备的能力,在实验中会因为操作而引起各种误差,引起数据的偏差,在数据的应用中一定要能进行取舍。对实验中的错误操作进行分析,得出引起实验数据偏差的原因。
【答题技巧】(1)通过数据分析可知,编号1组测得的NaOH溶液体积误差太大,为无效数据,应舍去。根据2、3组数据,可求出NaOH溶液的平均体积为20.00mL,所以NaOH溶液的物质的量浓度为:C(NaOH)=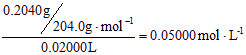 (2)B
(2)B

 化学是一门以实验为基础的自然科学,
化学是一门以实验为基础的自然科学,
化学实验在化学学习中具有重要的作用。
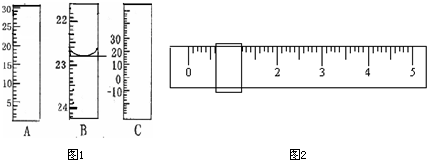
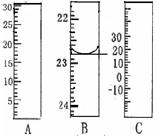
右图分别是温度计、量筒、滴定管的一部分,
其中A仪器的名称为 ,
B的正确读数为 。
(2)实验室很难配制准确浓度的NaOH溶液,需要
![]() 用基准物质来标定,邻苯二甲酸氢钾( ,,相对分子质量为204.0)是常用的基准物质。某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度。在本实验中达到滴定终点时,溶液的pH约为9.1。
用基准物质来标定,邻苯二甲酸氢钾( ,,相对分子质量为204.0)是常用的基准物质。某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度。在本实验中达到滴定终点时,溶液的pH约为9.1。
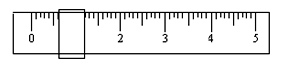 ①该学生用托盘天平称量时,先在两边托盘上放等质量的纸片,取少量邻苯二甲酸氢钾置于左盘,只用游码(单位:g)调整平衡时如下图所示。由此可知,所取邻苯二甲酸氢钾的质量为 g。
①该学生用托盘天平称量时,先在两边托盘上放等质量的纸片,取少量邻苯二甲酸氢钾置于左盘,只用游码(单位:g)调整平衡时如下图所示。由此可知,所取邻苯二甲酸氢钾的质量为 g。
②将称好的邻苯二甲酸氢钾置于锥形瓶中,加适量蒸馏水完全溶解得到无色溶液,再加入1~2滴 指示剂,当观察到 现象时,可停止滴定,记录数据。
③该学生进行了三次实验,所取固体质量均相同,达到滴定终点时记录所用未知氢氧化钠溶液的体积如下表:
| 实验编号 | NaOH溶液的体积(mL) |
| 1 | 22.52 |
| 2 | 22.49 |
| 3 | 22.50 |
则计算氢氧化钠溶液物质的量浓度的表达式为: (用数据表示,不需计算)
④以下操作会造成NaOH溶液浓度偏高的是 (填序号)
A.未用氢氧化钠溶液洗涤碱式滴定管
B.滴定前平视,滴定后俯视读数
C.滴定前滴定管尖嘴有气泡,滴定后气泡消失
D.滴定前未用邻苯二甲酸氢钾溶液洗锥形瓶

 ,相对分子质量为204.0)是常用的基准物质.某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度.在本实验中达到滴定终点时,溶液的pH约为9.1.
,相对分子质量为204.0)是常用的基准物质.某学生用邻苯二甲酸氢钾测定未知NaOH溶液的浓度.在本实验中达到滴定终点时,溶液的pH约为9.1. 某学生用邻苯二甲酸氢钾(相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1.
某学生用邻苯二甲酸氢钾(相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的pH约为9.1.