题目内容
【题目】取碳酸钠和碳酸氢钠的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g。回答下列问题:
(1)若取等质量的原混合物溶于水,配成80mL溶液,则c(Na+) = ______mol·L-1;
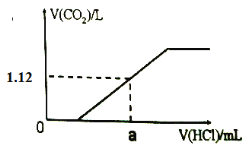
(2)向(1)所配溶液中逐滴滴加1mol·L-1的稀盐酸至过量,生成的CO2体积(标准状况下)与加入的盐酸体积有如下图关系(不考虑CO2在水中的溶解),则a点消耗盐酸的体积为_______mL。
【答案】1.5 80
【解析】
取碳酸钠和碳酸氢钠的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g,说明全部是碳酸钠,
⑴若取等质量的原混合物,根据钠守恒来分析,碳酸钠和碳酸氢钠的混合物8.22g,分解最后得到碳酸钠6.36g,物质的量为0.06mol,n(Na+) =0.06mol×2 =0.12mol,溶于水配成80mL溶液,则c(Na+) =![]() ,故答案为:1.5。
,故答案为:1.5。
⑵2NaHCO3![]() Na2CO3 + H2O + CO2↑ Δm
Na2CO3 + H2O + CO2↑ Δm
168g 62g
xg 8.22g-6.36g
![]()
解得x = 5.04g,物质的量为0.06mol,根据钠元素守恒,则碳酸钠中钠的物质的量为0.12mol – 0.06mol = 0.06mol,则碳酸钠的物质的量为0.03mol,向⑴所配溶液中逐滴滴加1mol·L-1的稀盐酸至过量,盐酸先与碳酸钠反应,将碳酸钠反应生成碳酸氢钠消耗0.03mol盐酸,再加盐酸产生1.12L二氧化碳气体即0.05mol,又消耗盐酸0.05mol,总消耗0.08mol盐酸,则a点消耗盐酸的体积![]() ,故答案为:80。
,故答案为:80。

练习册系列答案
相关题目