题目内容
(14分)
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,来制备甲醇。
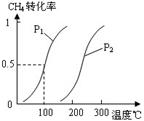
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图所示:
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图所示:
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
(2)在压强为0.1 MPa条件下, a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
③该反应的△H 0,△S 0(填“<”、“>”或“=”)。
④若容器容积不变,下列措施可增加甲醇产率的是
(3)在最新开发并投入生产的流动电解质直接甲醇燃料电池中,流动电解质硫酸的使用,可提高燃料电池效率约30%,该电池的负极反应为 。
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)
 CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图所示:
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图所示:①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。

(2)在压强为0.1 MPa条件下, a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)
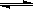 CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。③该反应的△H 0,△S 0(填“<”、“>”或“=”)。
④若容器容积不变,下列措施可增加甲醇产率的是
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1mol CO和3mol H2 |
(1)①0.0030mol·L-1·min-1(2分) ② <(2分); 2.25×10-4(2分)
(2)③<(2分)<(2分) ④ BD (2分)
(3)CH3OH + H2O - 6e- = CO2 + 6H+ (2分)
略

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
 4X(气)+nY(气),反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中n值是
4X(气)+nY(气),反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中n值是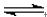 2HBr(g),此反应达到平衡的标志是
2HBr(g),此反应达到平衡的标志是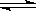 p C(g)的平衡常数为K,下列对K的说法正确的是
p C(g)的平衡常数为K,下列对K的说法正确的是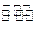 2C(g)+D(g);△H<0,建立平衡后,保持温度不变,增大加强,建立新平衡时,下列说法错误的是
2C(g)+D(g);△H<0,建立平衡后,保持温度不变,增大加强,建立新平衡时,下列说法错误的是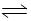 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( ) 内混合气体的平均摩尔质量不再随时间的变化而变化
内混合气体的平均摩尔质量不再随时间的变化而变化 qZ(g) ,若平衡时X、Y的转化率相等,说明反应开始时X.Y的物质的量之比为1:1
qZ(g) ,若平衡时X、Y的转化率相等,说明反应开始时X.Y的物质的量之比为1:1 xC(气)+yD(气),已知起始浓度A为5 mol/L,B为3 mol/L;C的反应速率为0.5 mol/( L·min);反应开始至平衡需2 min;平衡时D的浓度为0.5 mol/L。下列说法不正确的是( )
xC(气)+yD(气),已知起始浓度A为5 mol/L,B为3 mol/L;C的反应速率为0.5 mol/( L·min);反应开始至平衡需2 min;平衡时D的浓度为0.5 mol/L。下列说法不正确的是( ) =2∶1 D. D的反应速率为0.25 mol/(L·min)
=2∶1 D. D的反应速率为0.25 mol/(L·min)