题目内容
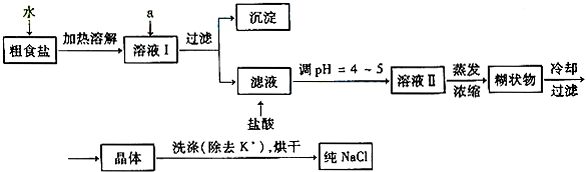
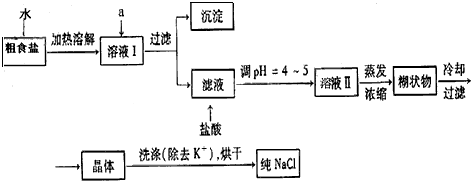
食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂。按滴加顺序依次为_________________(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_____________
(2)用提纯的NaCl配制500 mL4.00 mol/L。NaCl溶液,所用仪器除药匙、玻璃棒外还有__________________(填仪器名称)。
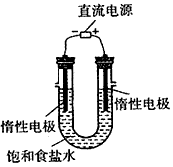
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2_______(填“>”、“=”或“<”)2L,原因是____________________。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为________________。
(4)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4==ZnSO4+H2↑ MnO2+4HCl(浓)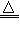 MnCl2+Cl2↑ +2H2O
MnCl2+Cl2↑ +2H2O
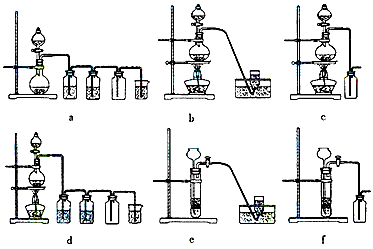
据此,从下列所给仪器装置中选择制备并收集H2的装置___________(填代号)和制备并收集干燥、纯净Cl2
的装置__________(填代号)。可选用制备气体的装置:
 MnCl2+Cl2↑ +2H2O
MnCl2+Cl2↑ +2H2O据此,从下列所给仪器装置中选择制备并收集H2的装置___________(填代号)和制备并收集干燥、纯净Cl2
的装置__________(填代号)。可选用制备气体的装置:
(1)①BaCl2、NaOH、Na2CO3;②75%乙醇
(2)天平、烧杯、500mL容量瓶、胶头滴管
(3)<;电解生成的氯气与电解生成的NaOH发生了反应;酸碱中和滴定
(4)c;d
(2)天平、烧杯、500mL容量瓶、胶头滴管
(3)<;电解生成的氯气与电解生成的NaOH发生了反应;酸碱中和滴定
(4)c;d

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目