题目内容
【题目】铜及其化合物在工业上有广泛的用途,回答下列问题:
(1)硫酸铜是一种具有氧化性的盐.
①制备生氢剂CuH,完成下列反应方程式:H3PO2+CuSO4+=CuH+H3PO4+H2SO4生成的CuH易在氯气中燃烧,则完全燃烧的产物是 .
②硫酸铜溶液可与白磷发生反应,产物为磷酸、硫酸和铜,则此反应的氧化产物与还原产物的物质的量之比为 .
(2)碱式碳酸铜在有机催化剤、烟火制造和颜料、农药生产中有广泛的应用.某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如图1: 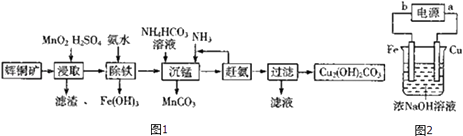
①辉铜矿在浸取前要ilfe富集与粉碎,粉碎的好处是 .
②浸取过程中得到一种单质,写出浸取时主要反应的化学方程式: .
③写出“沉锰”反应时离子方程式: .
(3)纳米Cu2O是一种新型光电材料,利用如图2所示的装置可制得,则工作中阳极上的电极反应式应 .
【答案】
(1)3;4;6H2O;4;3;4;CuCl2、HCl;2:5
(2)提高浸取速率;2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;Mn2++NH3+HCO3﹣=MnCO3↓+NH4+
(3)2Cu+2OH﹣→Cu2O+H2O+2e﹣
【解析】解:(1)①该反应的还原产物只有CuH,氧化产物只有H3PO4 , 每生成1molCuH得3mol电子,每生成1mol磷酸失去4mol电子,据电子守恒和原子守恒,配平方程式为:4CuSO4+3H3PO2+6H2O═4CuH↓+4H2SO4+3H3PO4;CuH在氯气中完全燃烧会生成氯化铜和氯化氢,所以答案是:3、4、6H2O、4、3、4;CuCl2、HCl;②硫酸铜溶液与白磷反应,产物为磷酸、硫酸和铜,氧化产物磷酸,还原产物为Cu,每生成1molCu转移2mol电子,每生成1mol磷酸转移5mol电子,据电子守恒,氧化产物与还原产物的物质的量之比为2:5,所以答案是:2:5;(2)①酸浸时,通过粉碎矿石或者升高温度或者进行搅拌或都增加酸的浓度,都可以提高浸取速率,
所以答案是:提高浸取速率;②反应物是二氧化锰、硫化铜和硫酸,生成物是S、硫酸铜、硫酸锰,反应的方程式为2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,
所以答案是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;③“沉锰”(除Mn2+)过程,主要是使Mn2+生成沉淀MnCO3 , 反应的离子方程式为Mn2++NH3+HCO3﹣=MnCO3↓+NH4+ , 所以答案是:Mn2++NH3+HCO3﹣=MnCO3↓+NH4+;(3)铜电极作阳极,阳极上铜失电子和氢氧根离子反应生成氧化亚铜,电极反应式为:2Cu+2OH﹣→Cu2O+H2O+2e﹣ , 所以答案是:2Cu+2OH﹣→Cu2O+H2O+2e﹣ .

【题目】判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.含氧酸酸性强弱与非羟基氧原子数的关系如表所示:
含氧酸 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
结构式 | Cl﹣OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
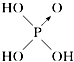
已知:亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性.由此可推出:
①H3PO3的结构式为 , H3PO3与过量的NaOH溶液反应的化学方程式为;
②H3AsO3的结构式为 , 在H3AsO3中加入浓盐酸,反应的化学方程式为 .