题目内容
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
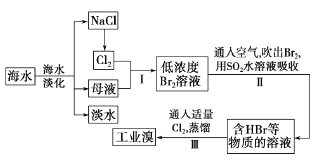
(1)请列举海水淡化的两种方法:________、_________。
(2)步骤I中己获得Br2,步骤II中又将Br2还原为Br-。其目的是_____。
(3)步骤II用SO2水溶液吸收Br2,吸收率可达95% 。有关反应的离子方程式为_________。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法。查阅了有关资料知:Br2的沸点为59 ℃.微溶于水,有毒并有强腐蚀性。他们参观生产过程后.画了如下装置简图:
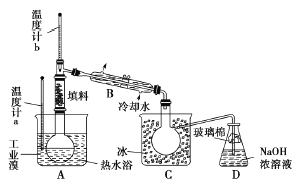
请你参与分析讨论:
①图中仪器B的名称是_______。
② 整套实验装皿中仪器连接均不能用橡胶塞和橡胶管。其原因是_______。
③ 实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?_______。
④ C中液体颜色为_______。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr,溶液,充分反应后.再进行的分离操作是_______。
【答案】(1)蒸馏法、电渗析法、离子交换法等中的任意两种;(2)富集溴元素;
(3)SO2+Br2+2H2O=4H++SO42-+2Br-;
(4) ①冷凝管;②溴具有强腐蚀性,可以腐蚀橡胶;③要控制温度计b的温度,并收集59℃时的馏分;④深红棕色;萃取、分液。
【解析】
试题分析:(1)海水淡化方法有蒸馏法、电渗析法、离子交换法等;(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素;(3)步骤II用SO2水溶液吸收Br2,Br2具有氧化性,SO2具有还原性,二者发生氧化还原反应,产生硫酸和HBr。根据原子守恒、电子守恒和电荷守恒,可得有关反应的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-;(4)①图中仪器B的名称是冷凝管;②整套实验装皿中仪器连接均不能用橡胶塞和橡胶管。其原因是反应过程中有溴单质的产生,溴具有强腐蚀性,可以腐蚀橡胶;③ 实验装置气密性良好,要达到提纯溴的目的,控制关键条件操作是要控制温度计b的温度,并收集59℃时的馏分;④ C中液体是液溴,颜色为深红棕色;为除去该产物中仍残留的少量Cl2,可向其中加入NaBr,溶液,发生反应:Cl2+2NaBr==2NaCl+Br2,然后利用溴单质溶于有机物而在水中溶解度小的性质,充分反应后.再进行萃取、分液的分离操作,就可以提纯溴单质。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】(1)用正确的序号填空: ①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3 ;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 断溶解 | C的质 量增加 | A上有气 体产生 |
根据实验现象回答下列问题:
①装置甲中作正极的是_____ ___ (填“A”或“B”)。
②装置乙溶液中Cu2+向_____ __极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于___ ___(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是____ ___。
【题目】
物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
乙 醇 | -117.0 | 78.0 | 0.79 |
乙 酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.90 |
浓硫酸(98%) | —— | 338.0 | 1.84 |
某学生在实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液。
②按如图1所示连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10分钟
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置,等待分层.
④分离出乙酸乙酯层并洗涤、干燥。
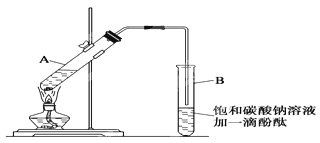
请根据题目要求回答下列问题:
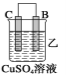
(1)配制该混合溶液的主要操作步骤为:______,写出制取乙酸乙酯的化学方程式:______.
(2)上述实验中饱和碳酸钠溶液的作用是:______(填字母)。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于其分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是:______。
(4)指出步骤③所观察到的现象:______;分离出乙酸乙酯层后,一般用饱和食盐水和饱和氯化钙溶液洗涤,可通过洗涤除去______(填名称)杂质;为了干燥乙酸乙酯,可选用的干燥剂为______(填字母)。
A.P2O5B.无水Na2SO4C.碱石灰 D.NaOH固体
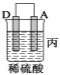
(5)某化学课外小组设计了如下图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图的装置相比,下图装置的主要优点有:____________、_________。(写出两条即可)