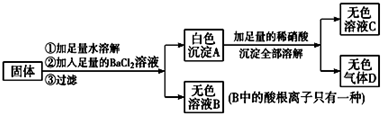
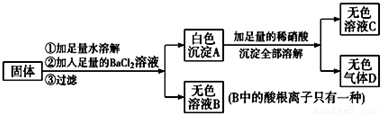
题目内容
某物质可能由:Ba(NO3)2、MgCl2、KOH、Al2(SO4)3中的一种或几种混合而成,溶于水后得到无色溶液.在此溶液中加入硝酸,先产生白色沉淀,而后白色沉淀又溶解.试回答下列问题:(1)该无色溶液所含上述物质中的
(2)滴加稀硝酸产生的白色沉淀是
分析:由“溶液中逐滴加入稀HNO3,先产生白色沉淀,而后白色沉淀又会溶解”可得溶液中含AlO2-,并由Al3+和过量OH-反应得到,因此溶液中所含的溶质为KOH(过量)和Al2(SO4)3,据此进行解答.
解答:解:(1)溶于水后得到无色溶液,在此溶液中加入硝酸,先产生白色沉淀,而后白色沉淀又溶解,说明原混合物溶于水后生成了AlO2-,AlO2-是Al3+和过量OH-反应生成的,故原溶液中一定存在KOH(过量)和Al2(SO4)3,反应的离子方程式为:Al3++4OH-=AlO2-+2H2O,由于Ba(NO3)2、MgCl2分别与硫酸铝、氢氧化钾反应生成难溶物,所以原混合物中一定不含Ba(NO3)2、MgCl2;
故答案为:KOH、Al2(SO4)3;Al3++4OH-=AlO2-+2H2O;
(2)滴加稀硝酸后,溶于中的偏铝酸根离子与氢离子反应生成了氢氧化铝沉淀,反应的离子方程式为:AlO2-+H2O+H+=Al(OH)3↓,
故答案为:Al(OH)3;AlO2-+H2O+H+=Al(OH)3↓.
故答案为:KOH、Al2(SO4)3;Al3++4OH-=AlO2-+2H2O;
(2)滴加稀硝酸后,溶于中的偏铝酸根离子与氢离子反应生成了氢氧化铝沉淀,反应的离子方程式为:AlO2-+H2O+H+=Al(OH)3↓,
故答案为:Al(OH)3;AlO2-+H2O+H+=Al(OH)3↓.
点评:本题考查了未知物的检验,题目难度中等,注意进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如本题中解题关键是明确铝离子与氢氧根离子的反应、偏铝酸根离子与氢离子的反应现象.

练习册系列答案
相关题目
某固体物质是由NaOH、AlCl3、K2SO4、CaCO3、Ba(NO3)2中的几种均匀混合而成,取样品进行如图所示实验(部分产物略去):
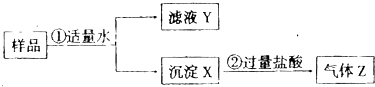
则下列判断正确的是( )

则下列判断正确的是( )
| A、沉淀X一定只含有CaCO3和BaSO4 | B、气体Z的成分无法确定 | C、取滤液Y,测得其pH>7,滤液Y中含有的含氧根离子可能是AlO2-、NO3- | D、向实验②后的溶液中滴加过量的烧碱,没有沉淀生成,说明肯定没有AlCl3 |
下列图示与对应的叙述相符的是( )
A、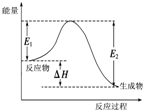 图中逆反应的热效应△H=E1-E2<0,所以逆反应为放热反应 | B、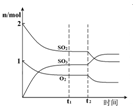 图表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | C、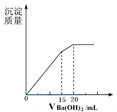 图表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 | D、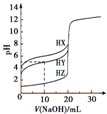 用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由图中曲线可确定HX的酸性最强 |