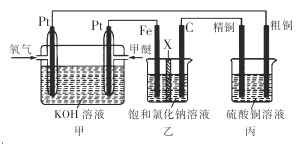
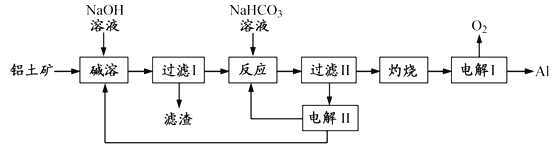
题目内容
【题目】(1)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS溶液的pH___7(填“>”“=”或“<”),理由是_________________________________。
(2)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
【答案】 > HS的水解常数为![]() >7.0×1015,水解程度大于电离程度,溶液显碱性,pH>7 5
>7.0×1015,水解程度大于电离程度,溶液显碱性,pH>7 5
【解析】(1)由于HS的水解常数为![]() >7.0×1015,水解程度大于电离程度,因此溶液显碱性,所以pH>7。(2)Mn2+开始沉淀时溶液中硫离子浓度是1.4×1015÷0.020 mol·L1 =7.0×1014,根据K2=7.0×1015可知溶液中氢离子浓度是
>7.0×1015,水解程度大于电离程度,因此溶液显碱性,所以pH>7。(2)Mn2+开始沉淀时溶液中硫离子浓度是1.4×1015÷0.020 mol·L1 =7.0×1014,根据K2=7.0×1015可知溶液中氢离子浓度是![]() ,所以a=5。
,所以a=5。

练习册系列答案
相关题目