题目内容
下列液体均处于25 ℃,有关叙述正确的是( )。
| A.某物质溶液的pH>7,则该物质一定是碱或强碱弱酸盐 |
| B.pH=6.5的牛奶中c(H+)是pH=4.5的H2SO4溶液中c(H+)的100倍 |
| C.pH=3的醋酸与pH=11的NaOH溶液等体积混合后溶液中: c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.AgCl在等浓度的CaCl2溶液和NaCl溶液中的溶解度相同 |
C
解析试题分析:A.25 ℃纯水的离子积常数为10-14,pH=7.某物质溶液的pH>7,则该物质一定是碱性溶液。可能是碱电离产生,也可能是强碱弱酸盐水解使溶液显碱性。会二者的混合溶液。错误。B.pH=6.5的牛奶中c(H+)=10-6.5mol/L。pH=4.5的H2SO4, c(H+)=10-4.5mol/L.所以它们的c(H+)的比为10-6.5:10-4.5=1:100.因此前者是后者的100分之一。错误。C.pH=3的醋酸,c(H+)=10-3mol/L, pH=11的NaOH溶液,c(OH-)=10-3mol/L由于醋酸是弱酸,部分电离,所以c(CH3COOH)> c(H+)=10-3mol/L当二者等体积混合时,电离的部分恰好与NaOH中和。由于醋酸过量所以溶液为CH3COOH和CH3COONa的混合液。由于CH3COOH酸的电离作用对于盐CH3COONa的水解作用,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。正确。D.AgCl在溶液中存在沉淀溶解平衡:AgCl(s)  Ag+(aq)+Cl-(aq).在等浓度的CaCl2溶液和NaCl溶液中c(Cl-)前者是后者的二倍。当把AgCl加入两种溶液时,由于CaCl2中的c(Cl-)大于NaCl中的c(Cl-),对AgCl(s)
Ag+(aq)+Cl-(aq).在等浓度的CaCl2溶液和NaCl溶液中c(Cl-)前者是后者的二倍。当把AgCl加入两种溶液时,由于CaCl2中的c(Cl-)大于NaCl中的c(Cl-),对AgCl(s)  Ag+(aq)+Cl-(aq)的抑制作用就大,所以AgCl在CaCl2溶液的溶解度就比在NaCl溶液中的小。错误。
Ag+(aq)+Cl-(aq)的抑制作用就大,所以AgCl在CaCl2溶液的溶解度就比在NaCl溶液中的小。错误。
考点:考查影响弱电解质的电离平衡机沉淀溶解平衡的因素和溶液中两种浓度的大小比较的知识。

25℃时,某溶液中只含有Na+、H+、OH-、A-四种离子。下列说法正确的是 ( )
| A.对于该溶液一定存在:pH≥7 |
| B.若c(OH-)>c(H+),则溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+) |
| C.若溶液中c(A-)= c(Na+),则溶液一定呈中性 |
| D.若溶质为NaA,则溶液中一定存在:c(Na+)>c(A-)>c(OH-)>c(H+) |
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为
0.1 mol·L-1的4种钠盐溶液的pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中正确的是( )
A.向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HS
 )>c(S
)>c(S )>c(OH-)
)>c(OH-) 常温下,浓度均为0.1 mol/L 的下列四种盐溶液,其pH测定如下表所示:
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
下列说法正确的是
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中, c(Na+) = c(CO32-)+c(HCO3-)+c(H2CO3)
某学生用碱式滴定管量取0.1 mol·L-1的NaOH溶液,开始时仰视液面读数为1.00 mL,取出部分溶液后,俯视液面,读数为11.00 mL,该同学在操作中实际取出的液体体积为( )
| A.大于10.00 mL | B.小于10.00 mL |
| C.等于10.00 mL | D.等于11.00 mL |
25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ,滴定曲线如下图所示。下列说法正确的是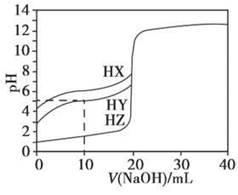
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B.根据滴定曲线,可得Ka(HY)≈10-5 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) |
D.HY与HZ混合,达到平衡时:c(H+)= +c(Z-)+c(OH-) +c(Z-)+c(OH-) |
常温下,向盛有1 L 0.1 mol·L-1 NaHSO4溶液的烧杯中不断滴加0.05 mol·L-1的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如下图所示,下列说法不正确的是
| A.A点时pH=1 |
| B.恰好完全沉淀时Ba(OH)2的体积为2 L |
C.B点时,溶液中的离子浓度关系为c(Na+)>c( )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
| D.C点时pH=14 |
已知:下表为25 ℃时某些弱酸的电离平衡常数。图像表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |

A.相同浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为2ClO-+CO2+H2O=2HClO+

C.图像中a、c两点处的溶液中
 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)D.图像中a点酸的总浓度大于b点酸的总浓度
下列事实不能说明一元酸HA为弱酸的是( )
| A.常温下0.1 mol·L-1的HA溶液pH为5 |
| B.常温下NaA溶液的pH>7 |
| C.HA溶液中存在H+、OH-、A-、HA |
| D.HA溶液能与大理石反应 |