题目内容
在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(S).2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol?L-1.下列判断错误的是( )
| A、x=1 | B、平衡时B与C的浓度之比为3:2 | C、A与B的转化率相等,均为40% | D、由体系中混合气体的密度不变,不能判断该反应已达到平衡状态 |
分析:依据化学平衡的三段式计算进行分析,结合题中各量列式计算判断;
A、利用物质的量之比等于化学计量数之比计算x的值;
B、根据平衡浓度求出比值;
C、利用转化率定义计算;
D、容器的容积不变,混合气体的质量减少,密度减少.
A、利用物质的量之比等于化学计量数之比计算x的值;
B、根据平衡浓度求出比值;
C、利用转化率定义计算;
D、容器的容积不变,混合气体的质量减少,密度减少.
解答:解:平衡时C的浓度为0.2mol?L-1,C的物质的量为0.2mol?L-1×2L=0.4mol,
3A(g)+B(g)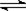 xC(g)+2D(g)
xC(g)+2D(g)
起始量(mol) 3 1 0 0
变化量(mol) 1.2 0.4 0.4 0.8
平衡量(mol) 1.8 0.6 0.4 0.8
依据上式分析计算:
A、物质的量之比等于化学计量数之比,故0.4mol:0.8mol=x:2,解得x=1,故A正确;
B、平衡时B与C的浓度分别为
,
,两者浓度之比为3:2,故B正确;
C、A与B的转化率分别为
=40%,
=40%,两者相等,故C正确;
D、容器的容积不变,混合气体的质量减少,密度减少,故体系中混合气体的密度不变,不能判断该反应已达到平衡状态,故D错误;
故选D.
3A(g)+B(g)
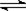 xC(g)+2D(g)
xC(g)+2D(g)起始量(mol) 3 1 0 0
变化量(mol) 1.2 0.4 0.4 0.8
平衡量(mol) 1.8 0.6 0.4 0.8
依据上式分析计算:
A、物质的量之比等于化学计量数之比,故0.4mol:0.8mol=x:2,解得x=1,故A正确;
B、平衡时B与C的浓度分别为
| 0.6mol |
| 2L |
| 0.4mol |
| 2L |
C、A与B的转化率分别为
| 1.2mol |
| 3mol |
| 0.4mol |
| 1mol |
D、容器的容积不变,混合气体的质量减少,密度减少,故体系中混合气体的密度不变,不能判断该反应已达到平衡状态,故D错误;
故选D.
点评:本题考查化学平衡的有关计算、转化率的有关计算、平衡状态的判断等,难度中等,注意平衡状态的判断,选择判断的物理量应随反应发生变化,该物理量不再变化,说明到达平衡.

练习册系列答案
相关题目
在一定条件下,在容积为2L的密闭容器中,将2mol L气体和3mol M气体相混合,发生如下反应: 2L(g)+ 3M(g) xQ(g)+ 3 R(g),4s后该反应达到平衡时,生成2.4molR,并测得Q的反应速率为0.1mol/(L·s),下列有关叙述正确的是
xQ(g)+ 3 R(g),4s后该反应达到平衡时,生成2.4molR,并测得Q的反应速率为0.1mol/(L·s),下列有关叙述正确的是
| A.x的值为2 | B.混合气体的密度变大 |
| C.L的转化率为80% | D.平衡时M的浓度为0.6mol/L |
 n C(g)+q D(s)。
n C(g)+q D(s)。
 xQ(g)+ 3 R(g),4s后该反应达到平衡时,生成2.4molR,并测得Q的反应速率为0.1mol/(L·s),下列有关叙述正确的是
xQ(g)+ 3 R(g),4s后该反应达到平衡时,生成2.4molR,并测得Q的反应速率为0.1mol/(L·s),下列有关叙述正确的是