��Ŀ����
����Ŀ�������£��÷�̪��ָʾ������0.10mol��L��1NaOH��Һ�ֱ�ζ�20.00mLŨ�Ⱦ�Ϊ0.10mol��L��1�� CH3COOH��Һ��HCN��Һ���õζ�������ͼ��
����֪��CH3COOH�� HCN�ĵ���ƽ�ⳣ���ֱ�Ϊ1.75��10-5��6.4��10-10��
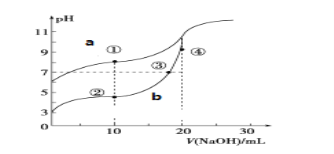
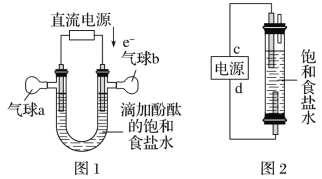
��1��ͼ__��a��b����NaOH��Һ�ζ�HCN��Һ��pH�仯�����ߣ��жϵ�������__��
��2�������ʾ��Һ����������Ũ�ȵĴӴ�С��˳��__��
��3����ٺ͵�� ��ʾ��Һ�У�c(CH3COO��)��c(CN��)__c(HCN)��c(CH3COOH)������>��<��=����
��4����ڢۢ���ʾ����Һ��ˮ�ĵ���̶��ɴ�С��˳���ǣ�__��
���𰸡�a HCN�ĵ���ƽ�ⳣ��С��ͬŨ�ȣ���������������Ũ��С��pHֵ�� c(CH3COO��)=c(Na+)>c(OH��)=c(H+) = �ܢۢ�
��������
��1������ƽ�ⳣ��ԽС����Խ����ͬŨ��pHֵԽ��
��2��bΪ���ᣬ���жϵ����ʾ��Һ�е����ʳɷ֣�������Һ�еĵ���غ������
��3�����ж����ʳɷ֣����ݸ���Һ�е������غ������
��4����ĵ�������ˮ�ĵ��룬�ε�ˮ��ٽ�ˮ�ĵ��룻
��1��������Ŀ������Ϣ��֪����ƽ�ⳣ��Ka(CH3COOH)> Ka(HCN)������ͬŨ�ȵ�CH3COOH��HCN��HCN�����Ը�ǿ��pHֵ��������aΪHCN��bΪCH3COOH���ʴ�Ϊ��a��HCN�ĵ���ƽ�ⳣ��С��ͬŨ�ȣ���������������Ũ��С��pHֵ��
��2������b�������ᣬ���ݼ����������Ƶ�����֪�����ʾ��Һ������ΪCH3COOH��CH3COONa�����ݵ���غ��֪��c(CH3COO��)+ c(OH��)= c(Na+) +c(H+)����ʱ��Һ�����ԣ�����c(OH��)=c(H+)������c(CH3COO��)=c(Na+)���ʴ�Ϊ��c(CH3COO��)=c(Na+)>c(OH��)=c(H+)��
��3�������ʾ��Һ������ΪCH3COOH��CH3COONa�������ʵ���֮��Ϊ1:1�����������غ��֪c(CH3COOH)+ c(CH3COO��)=2c(Na+)��ͬ����֪�����ʾ��Һ�У�c(HCN)+ c(CN��)=2 c(Na+)������Һ�����������Ƶ�����ͬ������������Ũ����ͬ����c(CH3COOH)+ c(CH3COO��)= c(HCN)+ c(CN��)������c(CH3COO��)��c(CN��)=c(HCN)��c(CH3COOH)��
��4�������ʾ��Һ������ΪCH3COOH��CH3COONa�������ʵ���֮��Ϊ1:1������ĵ���̶ȴ���ˮ��̶ȣ���ʱˮ�ĵ����ܵ����ƣ������ʾ��Һ������ΪCH3COOH��CH3COONa����ʱ��Һ�����ԣ���Һ��c(OH-)=10-7mol/L����ȫ����ˮ���룬��ĵ�����ε�ˮ���������ˮ�ĵ���Ȳ��ܵ�����Ҳ���ܵ��ٽ��������ʾ��Һ������ΪCH3COONa��ֻ���ε�ˮ��ٽ�ˮ�ĵ��룬����ˮ�ĵ���̶ȴӴ�С����Ϊ�ܢۢڣ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ij�о�С����ʵ����̽����������泥�NH2COONH4���ֽⷴӦƽ�ⳣ����ˮ�ⷴӦ���ʵIJⶨ��
��1����һ���������İ���������������Ƶ��ܱ���������У���������������䣬��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4��s��2NH3��g��+CO2��g����ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶ȣ��棩 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ����ѹǿ��kPa�� | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
ƽ��������Ũ�ȣ���10��3mol/L�� | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
�ٿ����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����___������ĸ����
A��2v��NH3��=v��CO2�� B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ��� D���ܱ������а����������������
�ڸ��ݱ������ݣ�����25.0��ʱ�ķֽ�ƽ�ⳣ��Ϊ___________ ��
��2����֪��NH2COONH4+2H2O![]() NH4HCO3+NH3H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c��NH2COO������ʱ��仯������ͼ��ʾ��
NH4HCO3+NH3H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c��NH2COO������ʱ��仯������ͼ��ʾ��
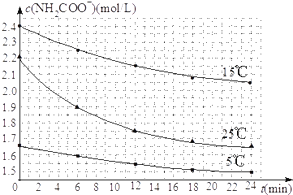
�ۼ���25��ʱ��0��6min���������ˮ�ⷴӦ��ƽ������Ϊ__________ ��
�ܸ���ͼ����Ϣ�����˵��ˮ�ⷴӦ��ƽ���������¶����߶�����________________ ��