��Ŀ����
����Ŀ��ƫ������(C2H8N2)�� N2O4 �dz��õĻ���ƽ����������£�1mol Һ̬ C2H8N2�� 2mol Һ̬ N2O4 ��ȫ��Ӧ������ CO2��N2��H2O ��������Ⱦ�����ͬʱ�ͷų��ߴ� 2250kJ ��������
(1)ƫ�������� N2O4 ��Ӧ���Ȼ�ѧ����ʽΪ_____
(2)��Ӧ�е���������_____
(3)�������ʱ�����ֺ���ɫ���壬ԭ��Ϊ��N2O42NO2 ���¶�����ʱ��������ɫ�����÷�ӦΪ_____�ȷ�Ӧ(����������������)
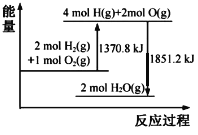
(4)�ֽ� 1mol N2O4 ����һ�������ܱ������У�����ʾ��ͼ��ȷ����˵�� N2O42NO2�ﵽƽ��״̬����_____(����ĸ)

(5)���о�֮������ѧ�������ǽ������Ը�ǿ��F2��Ӧ���ʼ��졢�ͷ��������ߵ�N5 �����ƽ��������ۺϷ������δ���ã����������ƽ���Ӧ�߱����ص���_____
���𰸡�C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)��H=-2250kJ/mol N2O4 �� c ��λ�����ͷ������ߡ����ﻷ������Ӧ�ɿ�
��������
(1)1molҺ̬C2H8N2��2molҺ̬N2O4��ȫ��Ӧ������CO2��N2��H2O��������Ⱦ�����ͬʱ�ͷų�2250kJ���������ݴ˿�֪�÷�Ӧ���Ȼ�ѧ����ʽΪC2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)��H=-2250kJ/mol��
(2)�÷�Ӧ��N2O4�е�Ԫ�ػ��ϼ۽��ͣ�Ϊ��������
(3)�¶�����������ɫ���˵��ƽ�������ƶ���NO2Ũ���������Ը÷�ӦΪ���ȷ�Ӧ��
(4)a���÷�Ӧǰ����������������䣬�������ݣ������ܶ�һֱ���䣬��a����
b����ʼͶ��Ϊ1molN2O4������v(��)N2O4�ڳ�ʼʱ�̲�Ϊ0����b����
c��������������ת���ʲ��䣬˵�����淴Ӧ������ȣ��ﵽ��ƽ��״̬����c��ȷ��
��������ѡc��
(5)������Ŀ��Ϣ��֪û�в��������Ը�ǿ��F2��Ӧ���ʼ��졢�ͷ��������ߵ�N5 �����ƽ�����˵������ƽ���������Ҫ��λ�����ͷ������ߡ����ﻷ����������Ҫ��Ӧ�ɿء�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ij��Һ������Fe2+��Cu2+��Cl-���л���ͭ���Ƶô�����FeCl3��Һ�������Ƶô�����FeCl3��ҺΪԭ����ȡ������ˮ�������������(K2FeO4)�����������£�

��֪���������(K2FeO4)λ����ɫ���壬������ˮ�������Ի�������Һ���ֽ⣬�ڼ�����Һ���ȶ���������ؾ���ǿ�����ԡ��������(K2FeO4)��ˮ���ò���Fe(OH)3��
��1�������Һ�к���Fe2+ѡ�õ��Լ���________���ѧʽ�����ӷ�Һ���Ƶô�����FeCl3��Һ������Լ��������⣬����Ҫһ���Լ���_________���ѧʽ��������ʱ������Ӧ�����ӷ���ʽΪ__________��
��2���������(K2FeO4)�ڴ���ˮ�����е�������_________��__________��
��3�������������̷�Ӧ�����ӷ���ʽΪ__________��
��4������ʱ���õIJ��������в��������ձ���________���������յõ��ĸ�����س�������־�������ؽᾧ���ᴿ�������ǣ����ֲ�Ʒ��_________�ܽ⣬Ȼ��________��
��5���û��յ�ͭΪԭ�Ͽ��Ƶô���CuSO4��5H2O���壨����������FeSO4��7H2O������ȥCuSO4��5H2O��������־�ķ����ǣ�����Һ�м���H2O2���ٵ�����ҺPH�����˼����Ƶô�����CuSO4��Һ�������Ƶô���CuSO4��5H2O�ľ��塣
��֪������ʱһЩ���ʵ�Kaq���±���
��ѧʽ | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
Kaq | 8.0��10-16 | 8.0��10-18 | 8.0��10-20 |
��֪��Һ�е�����Ũ��С��1��10-6mol��L-1ʱ���϶�������ȫ��
��˫��ˮ��Ŀ����__________������Һ��CuSO4��Ũ��Ϊ3.0mol��L-1��ͨ������˵���˷����ɳ�ȥ����CuSO4��5H2O������FeSO4��7H2O������________��