题目内容
(16分)已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同。F处于周期表中第9列。
(1)B、C、D三种元素的氢化物的沸点高低顺序为 ,稳定性顺序为 。
(2)同时含有A、B、D三种元素的化合物M是此类物质中为数不多的气体,且分子中所有原子共平面,则M中σ键和π键个数比为 ,B原子的杂化类型为 ,M能和水以任意比混溶的原因是 。
(3)C的最高价含氧酸根的空间构型为 ,E的基态原子的价电子排布式为
(4)“生物金属”E内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图。则E晶胞中E的配位数为 ,若该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,E原子的摩尔质量为M g/mol,则E原子的半径为 cm

(5)F可形成分子式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,产生的现象是 ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 。
(1)B、C、D三种元素的氢化物的沸点高低顺序为 ,稳定性顺序为 。
(2)同时含有A、B、D三种元素的化合物M是此类物质中为数不多的气体,且分子中所有原子共平面,则M中σ键和π键个数比为 ,B原子的杂化类型为 ,M能和水以任意比混溶的原因是 。
(3)C的最高价含氧酸根的空间构型为 ,E的基态原子的价电子排布式为
(4)“生物金属”E内部原子的堆积方式与铜相同,都是面心立方堆积方式,如图。则E晶胞中E的配位数为 ,若该晶胞的密度为a g/cm3,阿伏加德罗常数为NA,E原子的摩尔质量为M g/mol,则E原子的半径为 cm

(5)F可形成分子式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,产生的现象是 ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 。
(16分)(没作说明每空1分)
(1)CH4 < NH3< H2O ;CH4 < NH3< H2O
(2)3︰1;sp2杂化;甲醛能和水分子间形成氢键(2分)
(3)平面三角形(2分);3d24s2(2分)
(4)12;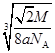 (2分)
(2分)
(5)产生白色沉淀;[Co(SO4)(NH3)5]Br(2分)
(1)CH4 < NH3< H2O ;CH4 < NH3< H2O
(2)3︰1;sp2杂化;甲醛能和水分子间形成氢键(2分)
(3)平面三角形(2分);3d24s2(2分)
(4)12;
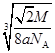 (2分)
(2分)(5)产生白色沉淀;[Co(SO4)(NH3)5]Br(2分)
A只能为氢元素;B为1s22s22p2,即为碳元素;而D为1s22s22p4,为氧元素,进而可推出C只能为氮元素;E为钛元素,F为钴元素
(1)B、C、D三种元素的非金属性依次增强,氢化物的稳定性也依次增强CH4 < NH3< H2O,而由于氨气、水中有氢键,氢化物沸点CH4 < NH3< H2O
(2)M为甲醛气体;其中的C原子sp2杂化,两个C—Hσ键、一个C—Oσ键和一个C—Oπ键;它与水可形成氢键,所以能与水与任意比互溶
(3)由NO3—的VSEPR模型可推出它为平面三角形空间结构
(4)E在三维面上的配位数共12个;
假设晶胞的连长为b,则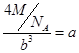 ,可知:b=
,可知:b=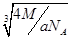 ,所以:
,所以:
E原子的半径为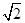 ×
×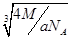 /4=
/4=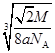
(5)[F(NH3)5Br]SO4,可电离出硫酸根离子,与BaCl2溶液混合时产生白色的硫酸钡沉淀,而[Co(SO4)(NH3)5]Br可电离出溴离子,与AgNO3溶液混合时产生溴化银淡黄色沉淀。
(1)B、C、D三种元素的非金属性依次增强,氢化物的稳定性也依次增强CH4 < NH3< H2O,而由于氨气、水中有氢键,氢化物沸点CH4 < NH3< H2O
(2)M为甲醛气体;其中的C原子sp2杂化,两个C—Hσ键、一个C—Oσ键和一个C—Oπ键;它与水可形成氢键,所以能与水与任意比互溶
(3)由NO3—的VSEPR模型可推出它为平面三角形空间结构
(4)E在三维面上的配位数共12个;
假设晶胞的连长为b,则
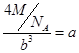 ,可知:b=
,可知:b=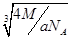 ,所以:
,所以:E原子的半径为
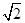 ×
×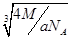 /4=
/4=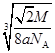
(5)[F(NH3)5Br]SO4,可电离出硫酸根离子,与BaCl2溶液混合时产生白色的硫酸钡沉淀,而[Co(SO4)(NH3)5]Br可电离出溴离子,与AgNO3溶液混合时产生溴化银淡黄色沉淀。

练习册系列答案
相关题目







