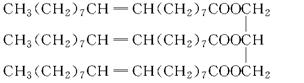题目内容
将含有C、H、O的有机物3.0g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过装有CaCl2(A)和碱石灰(B)的干燥管,测得A管质量增加了1.8 g,B管质量增加了4.4 g,已知该有机物的相对分子质量为60。(1)燃烧此有机物3.0 g需消耗O2(标准状况) L;(2)求此有机物的分子式 。
(1)2.24L (2)C2H4O2
解析试题分析:(1)根据质量守恒定律可知燃烧此有机物3.0 g需消耗O2的质量为1.8 g +4.4 g -3.0g =3.2g.n(O2)=3.2g÷32g/mol=0.1mol.所以在标准状况下其体积为2.24L。(2)n(H2O)= 1.8 g÷ 18g/mol= 0.1mol;n(CO2)= 4.4 g÷44g/mol=0.1mol。所以在3.0g该有机物中,含有H:0.2mol;C:0.1mol;O:(3.0g-0.2mol×1g/mol-0.1mol×12g/mol)÷16g/mol=0.1mol。所以该化合物的最简式是CH2O,其式量为30. 因为该有机物的相对分子质量为60。所以该化合物的分子式为C2H4O2。
考点:考查质量守恒定律、有机物的燃烧规律及物质化学式的确定的知识。

练习册系列答案
相关题目
有机物X能实现下列转化:有机物X→葡萄糖→有机物Y→乙醛.下列判断错误的是( )
| A.X可以是淀粉或纤维素 | B.Y与CH3OCH3是同分异构体 |
| C.Y可以用于消除少量钠屑 | D.Y→乙醛属于消去反应 |
(15分)某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如表:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
在圆底烧瓶中加入12.2 g苯甲酸和20 mL甲醇(密度约为0.79 g·cm-3),再小心加入3mL浓硫酸,混匀后,投入几块碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
⑴浓硫酸的作用是________________________________________ _________;
若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式
___________________________________________________。
⑵甲和乙两位同学分别设计了如图所示的两套实验室合成苯甲酸甲 酯的装置 (夹持仪器和加热仪器均已略去)。

根据有机物的沸点,最好采用______(填“甲”或“乙”)装置。
理由是______________________________________________。
⑶若要提高苯甲酸甲酯的产率,可采取的措施_
______ _。(任写一条)
Ⅱ.粗产品的精制
⑷苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填入操作方法的名称。

⑸通过计算,苯甲酸甲酯的产率为__________________________________。