ЬтФПФкШн
ЁОЬтФПЁП700ЁцЪБЃЌЯђШнЛ§ЮЊ2LЕФУмБеШнЦїжаГфШывЛЖЈСПЕФCOКЭH2OЃЌЗЂЩњЗДгІЃКCOЃЈgЃЉ+H2OЃЈgЃЉCO2ЃЈgЃЉ+H2ЃЈgЃЉЗДгІЙ§ГЬжаВтЖЈЕФВПЗжЪ§ОнМћЯТБэЃЈБэжаt2ЃОt1ЃЉЃК
ЗДгІЪБМф/min | NЃЈCOЃЉ/mol | NЃЈH2OЃЉ/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
ЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.ЗДгІдкt1minФкЕФЦНОљЫйТЪЮЊvЃЈH2ЃЉЃН![]() molL-1min
molL-1min
B.БЃГжЦфЫћЬѕМўВЛБфЃЌЦ№ЪМЪБЯђШнЦїжаГфШы0.60molCOКЭ1.20mol H2OЃЌДяЕНЦНКтЪБnЃЈCO2ЃЉЃН0.40mol
C.БЃГжЦфЫћЬѕМўВЛБфЃЌЯђЦНКтЬхЯЕжадйЭЈШы0.20mol H2OЃЌгыдЦНКтЯрБШЃЌДяЕНаТЦНКтЪБCOзЊЛЏТЪВЛБфЃЌH2OЕФЬхЛ§ЗжЪ§ВЛБф
D.ЮТЖШЩ§ИпжС800ЁцЃЌЩЯЪіЗДгІЦНКтГЃЪ§ЮЊ0.64ЃЌдђе§ЗДгІЮЊЮќШШЗДгІ
ЁОД№АИЁПB
ЁОНтЮіЁП
A.vЃЈCOЃЉЃН![]() ЃН
ЃН![]() molLЉ1minЃЌvЃЈCOЃЉЃКvЃЈH2ЃЉЃН1ЃК1ЃЌдђvЃЈH2ЃЉЃН
molLЉ1minЃЌvЃЈCOЃЉЃКvЃЈH2ЃЉЃН1ЃК1ЃЌдђvЃЈH2ЃЉЃН![]() molLЉ1minЃЌЙЪAДэЮѓЃЛ
molLЉ1minЃЌЙЪAДэЮѓЃЛ
B.t1minЪБЃЌnЃЈCOЃЉЃН0.8molЃЌnЃЈH2OЃЉЃН0.6molЉ0.4molЃН0.2molЃЌt2minЪБnЃЈH2OЃЉЃН0.2molЃЌЫЕУїt1minЪБЗДгІвбОДяЕНЛЏбЇЦНКтзДЬЌЃЌnЃЈCO2ЃЉЃНnЃЈH2ЃЉЃН0.4molЃЌKЃН![]() ЃН
ЃН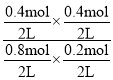 ЃН1ЃЌЦ№ЪМГфШы1.2molCOКЭ1.20molH2OЃЌМйЩшДяЕНЦНКтЪБnЃЈCO2ЃЉЃН0.40 molЃЌдђnЃЈCOЃЉЃН0.6molЉ0.4molЃН0.2molЃЌnЃЈH2OЃЉЃН1.2molЉ0.4molЃН0.8molЃЌnЃЈH2ЃЉЃНnЃЈCO2ЃЉЃН0.4molЃЌQcЃН
ЃН1ЃЌЦ№ЪМГфШы1.2molCOКЭ1.20molH2OЃЌМйЩшДяЕНЦНКтЪБnЃЈCO2ЃЉЃН0.40 molЃЌдђnЃЈCOЃЉЃН0.6molЉ0.4molЃН0.2molЃЌnЃЈH2OЃЉЃН1.2molЉ0.4molЃН0.8molЃЌnЃЈH2ЃЉЃНnЃЈCO2ЃЉЃН0.4molЃЌQcЃН ЃН1ЃНKЃЌЫЕУїДЫЪБДяЕНЛЏбЇЦНКтзДЬЌЃЌМйЩшГЩСЂЃЌЙЪBе§ШЗЃЛ
ЃН1ЃНKЃЌЫЕУїДЫЪБДяЕНЛЏбЇЦНКтзДЬЌЃЌМйЩшГЩСЂЃЌЙЪBе§ШЗЃЛ
C.БЃГжЦфЫћЬѕМўВЛБфЃЌЯђЦНКтЬхЯЕжадйЭЈШы0.20molH2OЃЌЦНКтЯђе§ЗДгІЗНЯђвЦЖЏЃЌДяЕНЦНКтЪБCOзЊЛЏТЪдіДѓЃЌH2OЕФЬхЛ§ЗжЪ§ЛсдіДѓЃЌЙЪCДэЮѓЃЛ
D.800ЁцЃЌЗДгІЦНКтГЃЪ§ЮЊ0.64ЃЌгЩBЕУ700ЁцЃЌЗДгІЦНКтГЃЪ§ЮЊ1ЃЌЩ§ИпЮТЖШЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌИУЗДгІЪЧЗХШШЗДгІЃЌЙЪDДэЮѓЃЌ
ЙЪбЁЃКBЁЃ

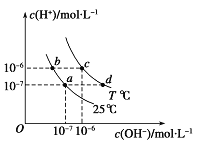
ЁОЬтФПЁПГЃЮТЯТХЈЖШОљЮЊ0.1mol/L ЕФЫФжжбЮШмвКЃЌЦфpH ШчБэЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
ађКХ | Ђй | Ђк | Ђл | Ђм |
ШмвК | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. НЋЕШХЈЖШЕФCH3COOH КЭHClOШмвКЃЌpHаЁЕФЪЧHClO
B. Na2CO3КЭNaHCO3ШмвКжаСЃзгжжРрВЛЭЌ
C. ШмвКЫЎЕФЕчРыГЬЖШЃКЂй>Ђк>Ђм>Ђл
D. NaHCO3ШмвКжаЃКc (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
ЁОЬтФПЁПИљОнЯТБэжаЕФаХЯЂХаЖЯЃЌЯТСаЫЕЗЈДэЮѓЕФЪЧ
ађКХ | ЗДгІЮя | ВњЮя |
Ђй | Cl2ЁЂH2O2 | ClЃЁЂЁЁ |
Ђк | Cl2ЁЂFeBr2 | FeCl3ЁЂFeBr3 |
Ђл | KClO3ЁЂHCl | Cl2ЁЂKClЁЂH2O |
A.ЕкЂйзщЗДгІЕФбѕЛЏВњЮяЮЊO2
B.ЕкЂкзщЗДгІжаC12гыFeBr2ЕФЮяжЪЕФСПжЎБШаЁгкЛђЕШгк1ЃК2
C.ЕкЂлзщЗДгІжаЩњГЩ3mol C12ЃЌзЊвЦ6molЕчзг
D.бѕЛЏадгЩЧПЕНШѕЕФЫГађЮЊC1O3Ѓ >C12>Fe3+