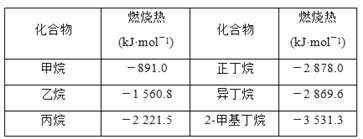
题目内容
【题目】当前材料科学的发展方兴未艾。B、N、Ti、Fe都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态Fe2+的电子排布式为_____________________________
(2)BF3分子空间结构为___________;在NH3中N原子的杂化方式为_______。
(3)科学家目前合成了N4分子,结合等电子体相关内容判断该分子中N—N键的键角为__________。
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图所示。化合物乙的沸点明显高于化合物甲,主要原因是_________________________________________
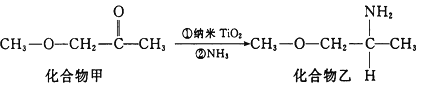
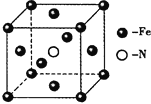
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如右上图所示。若该晶体的密度是ρ g·cm-3,则两个最近的Fe原子间的距离为_____________cm。(阿伏加德罗常数用NA表示)
【答案】 1s22s22p63s23p63d6或[Ar]3d6 平面正三角形 sp3 60° 化合物乙分子间存在氢键 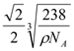
【解析】(1)铁原子失去最外层4s能级2个电子,形成Fe2+,核外电子排布式为:1s22s22p63s23p63d6或[Ar]3d6,故答案为:1s22s22p63s23p63d6或[Ar]3d6;
(2)BF3中B原子含有3个σ键且不含孤电子对,所以BF3为平面三角形构型;NH3分子中氮原子含有孤电子对,NH3中N原子含有3个σ键和1个孤电子对,所以NH3为三角锥构型,N原子的杂化方式为sp3,故答案为:平面正三角形;sp3;
(3)N4分子中N原子形成3个σ键、含有1对孤对电子,杂化轨道数目为4,N原子采取sp3杂化,每个面为正三角形,N-N 键的键角为60°,故答案为:60°;
(4)氢键的存在导致物质熔沸点升高,乙中含有氢键、甲不含氢键,所以化合物乙熔沸点高于甲,故答案为:化合物乙分子间存在氢键;
(5)该晶胞中铁原子个数=8×![]() +6×
+6×![]() =4,氮原子个数是1,所以氮化铁的化学式是Fe4N,一个晶胞中Fe原子数目为8×
=4,氮原子个数是1,所以氮化铁的化学式是Fe4N,一个晶胞中Fe原子数目为8×![]() +6+×
+6+×![]() =4,N原子数目为1,晶胞棱长a=
=4,N原子数目为1,晶胞棱长a=![]() =
=![]() =
=![]() ,则两个最近的Fe原子间的距离为
,则两个最近的Fe原子间的距离为![]() a=
a=![]() ×
×![]() ,故答案为:
,故答案为: ![]() ×
×![]() 。
。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案【题目】元素周期表是学习和研究化学的重要工具.请根据下表(元素周期表的部分内容)回答有关问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥIA | VIIA | 0 |
2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne |
3 | 11 Na | 12Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar |
(1)请从上表中查出关于硼元素的一条信息: .
(2)表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的相同.
(3)第11号元素与第17号元素组成的化合物是 , 构成该物质的微粒是(选填“分子”、“原子”或“离子”).
(4)如图A、B、C是三种粒子的结构示意图.试回答下列问题: 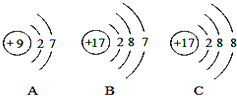
①A、B、C中属于同种元素的粒子是;
②A和B两种粒子的相同,所以它们具有相似的化学性质.