题目内容
【题目】甲、乙、丙三种物质存在如图所示的转化关系(图中“→”表示一步转化)。下列各组物质转化,不能满足此关系的是
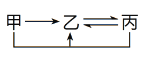
甲 | 乙 | 丙 | |
A | NaOH | Na2CO3 | NaHCO3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | NH3 | N2 | HNO3 |
D | S | SO2 | H2SO4 |
A. A B. B C. C D. D
【答案】C
【解析】A.甲→乙,2NaOH+CO2![]() Na2CO3+H2O,乙
Na2CO3+H2O,乙![]() 丙,Na2CO3+H2O+CO2
丙,Na2CO3+H2O+CO2![]() 2NaHCO3,2NaHCO3
2NaHCO3,2NaHCO3![]() Na2CO3+H2O+CO2↑,甲+丙→乙,NaHCO3+NaOH
Na2CO3+H2O+CO2↑,甲+丙→乙,NaHCO3+NaOH![]() Na2CO3+H2O ,故A不符合题意;B. 甲→乙,AlCl3+3NaOH
Na2CO3+H2O ,故A不符合题意;B. 甲→乙,AlCl3+3NaOH![]() Al(OH)3↓+3NaCl,乙
Al(OH)3↓+3NaCl,乙![]() 丙,Al(OH)3+NaOH
丙,Al(OH)3+NaOH![]() NaAlO2+2H2O,NaAlO2+HCl+H2O
NaAlO2+2H2O,NaAlO2+HCl+H2O![]() Al(OH)3↓+NaCl,甲+丙→乙,3NaAlO2+AlCl3
Al(OH)3↓+NaCl,甲+丙→乙,3NaAlO2+AlCl3![]() 4Al(OH)3↓+3NaCl ,故B不符合题意; C. 乙→丙,不能一步转化,故C符合题意;D.甲→乙,S+ O2
4Al(OH)3↓+3NaCl ,故B不符合题意; C. 乙→丙,不能一步转化,故C符合题意;D.甲→乙,S+ O2![]() SO2,乙
SO2,乙![]() 丙,SO2+H2O2
丙,SO2+H2O2![]() H2SO4,C+2H2SO4(浓)
H2SO4,C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,甲+丙→乙,S+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,甲+丙→乙,S+2H2SO4(浓) ![]() 3SO2↑+2H2O,故D不符合题意。故选C。
3SO2↑+2H2O,故D不符合题意。故选C。

【题目】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。利用甲醛一定条件下直接脱氢可制甲醛,反应方程式:CH3OH(g)![]() HCHO(g)+H2(g) △H1
HCHO(g)+H2(g) △H1
实验测得随温度升高,平衡常数如下表所示。
温度(K) | 500 | 700 | T1 | T2 | T3 |
平衡常数 | 7.13×10-4 | 3.30×10-1 | 2.00 | 9.00 | 10.00 |
(1)甲醛分子中所有原了都达到稳定结构,甲醛的电子式为_____________。
(2) 若在恒温恒压容器中进行上述反应,可判断反应到达平衡状态的是_______________。
A.混合气体的密度不变
B.CH3OH、HCHO的物质的量浓度之比为1:1
C.H2的体积分数不再改变
D.单位时间内甲醛的生成量与氢气的消耗量相等
(3)T1时,CH3OH、HCHO、H2 起始浓度(mol·L-1)分别为1.0、0.50 、1.0,反应达到平衡时,HCHO 的体积分数___________20% (填“>”、“ =”、“ <”)。
(4)工业上采用膜分离器(对氢气具有很高的选择性和透过率)催化脱氢,装置如下图。为探究转化率变化,分别在普通反应器和膜反应器中,改变原料气压强,控制相同温度,经过相同反应时间,测定甲醇转化率,实验结果如下图。
①A点:v正______v逆(填“>”、“ =”、“ <”),理由是____________;
②B点比A点转化率高的原因是_______________。

(5)体系中加入一定量氧气有利于甲醛的生成。反应体系中存在下列反应:
CH3OH(g)+1/2O2(g)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
H2(g)+12O2(g)![]() H2O(g) △H3
H2O(g) △H3
则△H2、△H3的大小关系是△H2________△H3(填“>”、“ =”、“ <”)。


