题目内容
 Ⅰ同素异形体相互转化的反应热相当少而且转化速率较慢,有时还很不完全,测定反应热很困难,现在可根据盖斯定律进行计算.
Ⅰ同素异形体相互转化的反应热相当少而且转化速率较慢,有时还很不完全,测定反应热很困难,现在可根据盖斯定律进行计算.已知:P4(s,白磷)+5O2(g)=P4O10(s)△H=-2983.2kJ?mol-1 ①
P(s,红磷)+
| 5 |
| 4 |
| 1 |
| 4 |
(1)试写出白磷转化为红磷的热化学方程式
(2)由热化学方程式来看,更稳定的磷的同素异形体是
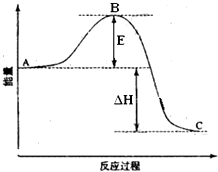
Ⅱ(6分)2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
(1)图中E的大小对该反应的反应热有无影响?
(2)图中△H=
分析:Ⅰ、(1)根据盖斯定律可以计算化学反应的焓变,进而书写热化学方程式;
(2)物质具有的能量越低越稳定.
Ⅱ、(1)A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比.
(2)物质具有的能量越低越稳定.
Ⅱ、(1)A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比.
解答:解:(1)红磷转化为白磷的化学方程式为:4P(s、红磷)=P4(s、白磷),可以看成是下列两个反应方程式的和:P4(s、白磷)+5O2(g)=P4O10(s);△H=-2983.2kJ?mol-1;P4O10(s)=4P(s、红磷)+5O2(g);△H=738.5×4kJ?mol-1=2954kJ?mol-1;
根据盖斯定律,白磷转化为红磷的热化学方程式P4(s、白磷)=4P(s、红磷)△H=-2983.2kJ/mol+2954kJ?mol-1=-29.2KJ/mol,
故答案为:P4(s、白磷)=4P(s、红磷)△H=-29.2KJ/mol;
(2)根据红磷转化为白磷的热化学方程式可知过程是一个吸热反应,所以红磷具有的能量低于白磷,能量越低越稳定,所以白磷的稳定性比红磷弱,故答案为:红磷;
Ⅱ、(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,加入催化剂能降低反应的活化能,加快化学反应速率,故答案为:无影响;降低;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1,故答案为:-198.
根据盖斯定律,白磷转化为红磷的热化学方程式P4(s、白磷)=4P(s、红磷)△H=-2983.2kJ/mol+2954kJ?mol-1=-29.2KJ/mol,
故答案为:P4(s、白磷)=4P(s、红磷)△H=-29.2KJ/mol;
(2)根据红磷转化为白磷的热化学方程式可知过程是一个吸热反应,所以红磷具有的能量低于白磷,能量越低越稳定,所以白磷的稳定性比红磷弱,故答案为:红磷;
Ⅱ、(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,加入催化剂能降低反应的活化能,加快化学反应速率,故答案为:无影响;降低;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ?mol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ?mol-1,故答案为:-198.
点评:本题考查反应过程的能量变化图以及运用盖斯定律进行反应热的计算,难度不大,注意活化能与反应热的关系.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
