题目内容
【题目】X、Y、Z、M、R是原子序数依次增大的短周期主族元素,X在周期表中原子半径最小,Y与Z相邻,Z、R在地壳中的含量位列前两位,M为短周期中电负性最小的元素。请回答:
(1)基态Z原子的外围电子排布图为____________。
(2)X与Y能形成多种化合物,其中Y2X2分子中σ键、π键的数目之比为_______。
(3)在R3Y4晶体中键角:Y-R-Y____R-Y-R(填“>”“<”或“=”),原因为________。
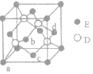
(4)钨(W)元素可以和Z、M形成多种化合物,其中一种化合物的晶体结构如图:
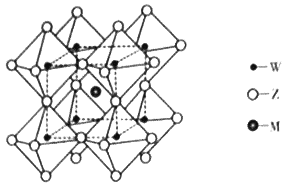
已知:相邻Z原子的核间距为apm,钨原子位于Z原子形成的正八面体的体心,M离子位于钨原子形成的立方体的体心。
①与M原子距离最近且相等的Z原子的数目为_________。
②晶体的化学式为__________。
③设NA为阿伏加德罗常数的值,则晶体的密度为______g/cm3(列出表达式)。
【答案】 ![]() 3:1 > Si3N4晶体中Si和N原子均为sp3杂化,但N原子含有1对孤对电子,孤对电子对成键电子的排斥作用更大,使得Si—N—Si键角小于109°28′ 12 NaWO3
3:1 > Si3N4晶体中Si和N原子均为sp3杂化,但N原子含有1对孤对电子,孤对电子对成键电子的排斥作用更大,使得Si—N—Si键角小于109°28′ 12 NaWO3 ![]()
【解析】X、Y、Z、M、R是原子序数依次增大的短周期主族元素,X在周期表中原子半径最小,X为H元素;Z、R在地壳中的含量位列前两位,则Z为O元素,R为Al元素;Y与Z相邻,则Y为N元素,M为短周期中电负性最小的元素,即金属性最强的元素,M为Na元素。
(1)Z为O元素,基态O原子的外围电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)X与Y能形成多种化合物,其中Y2X2为H2N2,结构为H-N=N-H分子中σ键、π键的数目之比为3:1,故答案为:3:1;
(3)Si3N4晶体中Si和N原子均为sp3杂化,但N原子含有1对孤对电子,孤对电子对成键电子的排斥作用更大,使得Si—N—Si键角小于109°28′,故答案为:> ;Si3N4晶体中Si和N原子均为sp3杂化,但N原子含有1对孤对电子,孤对电子对成键电子的排斥作用更大,使得Si—N—Si键角小于109°28′;
(4)①钨原子位于Z原子形成的正八面体的体心,被6个氧离子包围成配位八面体;钠离子位于钨原子形成的立方体的体心,被12个氧离子包围,故答案为:12;
②钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围;每个晶胞中钛离子和钙离子均为1个,晶胞的12个边长上各有一个氧原子,根据均摊原则,每个晶胞实际占有氧原子数目为12×![]() =3,则晶胞的化学式为NaWO3,故答案为:NaWO3;
=3,则晶胞的化学式为NaWO3,故答案为:NaWO3;
③相邻Z原子的核间距为apm=a×10-10cm,则晶胞的边长为2×![]() a×10-10cm=
a×10-10cm=![]() a×10-10cm ,则晶体的密度为
a×10-10cm ,则晶体的密度为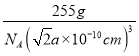 =
=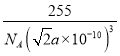 g/cm3,故答案为:
g/cm3,故答案为: 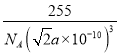 。
。