题目内容
用双线桥表示下列反应中得失电子的情况,并按要求回答:
3FeO + 10HNO3= 3Fe(NO3)3 + NO↑ + 5H2O.
(1)氧化剂是 ;氧化产物是 。
(2)在参加反应的硝酸中,起氧化剂(被还原)作用的HNO3与起酸性作用的HNO3的质量比为 。
(3)用双线桥标明电子转移的方向和数目 。
3FeO + 10HNO3= 3Fe(NO3)3 + NO↑ + 5H2O.
(1)氧化剂是 ;氧化产物是 。
(2)在参加反应的硝酸中,起氧化剂(被还原)作用的HNO3与起酸性作用的HNO3的质量比为 。
(3)用双线桥标明电子转移的方向和数目 。
(1)HNO3,Fe(NO3)3 (2)1:9
(3)
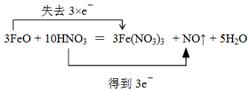
试题分析:(1)得到电子,所含元素化合价降低的反应物是氧化剂,氧化剂被还原生成还原产物。反之就是失去电子,所含元素化合价升高的反应物是还原剂,还原剂被氧化生成氧化产物。根据方程式可知,铁元素的化合价从+2价升高到+3价,所以氧化亚铁是还原剂,硝酸铁是氧化产物;硝酸中氮元素的化合价从+5价降低到+2价,得到电子,因此硝酸是氧化剂,NO是还原产物。
(2)如果设氧化亚铁是1mol,则生成1mol硝酸铁,即没有被还原的硝酸是3mol。根据电子的得失守恒可知,被还原的硝酸是1mol÷3,所以在参加反应的硝酸中,起氧化剂(被还原)作用的HNO3与起酸性作用的HNO3的质量比1/3︰3=1︰9。
(3)用双线桥标明电子转移的方向和数目起点和终点都是同一种元素,所以根据(1)、(2)分析可知,应该是
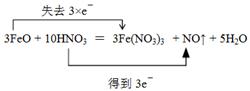
点评:在进行氧化还原反应的有关判断计算时,应该仅仅抓住电子得失守恒这一关系式进行列式计算。

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
 2Fe+Al2O3
2Fe+Al2O3 2MgO+C
2MgO+C 2NH3
2NH3 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2 +8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。
+8H2O若生成11.2LNO(标准状况),则反应中转移电子的物质的量为__________。 2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。
2SO42-+I2通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe2+对上述反应的催化过程:____________________________、______________________________。 Se+I2+KNO3+H2O
Se+I2+KNO3+H2O