题目内容
8.下列解释实验事实的离子方程式正确的是( )| A. | 纯碱溶液显碱性的原因:CO32-+2H2O?H2CO3+2OH- | |
| B. | 氯化铁溶液腐蚀铜线路板Cu+Fe3+=Cu2++Fe2+ | |
| C. | 稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 氯气溶于水:Cl2+H2O=H++Cl-+HClO |
分析 A.以第一步水解为主;
B.电荷不守恒;
C.生成物的计量数关系错误;
D.氯气和水反应生成盐酸和次氯酸,次氯酸为弱酸.
解答 解:A.以第一步水解为主,离子方程式为CO32-+H2O?HCO3-+OH-,故A错误;
B.电荷不守恒,应为Cu+2Fe3+=Cu2++2Fe2+,故B错误;
C.生成物的计量数关系错误,应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故C错误;
D.氯气和水反应生成盐酸和次氯酸,次氯酸为弱酸,离子方程式为Cl2+H2O=H++Cl-+HClO,故D正确.
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的化学反应为解答的关键,侧重复分解以及氧化还原反应的考查,注重分析能力与知识综合应用能力的训练,题目难度不大.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
18.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 2g H2含有的氢原子数目为NA | |
| B. | 常温常压下,22.4 LO2含有的分子数目为NA | |
| C. | 1 molZn转变为Zn2+失去的电子数目为NA | |
| D. | 1 L 1mol•L-1KOH溶液中含有的钾离子数目为NA |
16.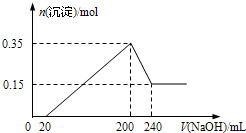 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )| A. | Mg和Al的总质量为8 g | |
| B. | 硫酸的物质的量浓度为5 mol/L | |
| C. | NaOH溶液的物质的量浓度为5 mol/L | |
| D. | 生成的H2在标准状况下的体积为11.2 L |
13.将乙醛和乙酸分离的正确方法是( )
| A. | 加热蒸馏 | |
| B. | 利用银镜反应进行分离 | |
| C. | 加入Na2CO3后,通过萃取的方法分离 | |
| D. | 先加入烧碱溶液,之后蒸馏出乙醛;再加入浓硫酸,蒸馏出乙酸 |