��Ŀ����
����Ŀ�����ڷ��ֵ�һ����Ȼ��������Al��Cu��Fe����Ԫ����ɣ��ش��������⣺
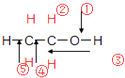
��1������һ����ƽ�����������ϸ�����λ����Ķ��ؾ��壬��ͨ���������־��塢����ͷǾ��壮
��2����̬��ԭ����_��δ�ɶԵ��ӣ����������ӵĵ����Ų�ʽΪ �� ���������ӱȶ��������ӵ��ȶ��Ը��ã�ԭ���� ��
��3�����Ʊ���������ͭ�ɽ���ȩ����Ϊ���ᣬ��������ԭ��������ͭ����ȩ��̼ԭ�ӵ��ӻ��������Ϊ������ķе����Ը�����ȩ������Ҫԭ���� ��
��4��������ͭ��Һ�м������KCN�����������[Cu��CN��4]2�� �� ���γ���λ��ʱ�����Ե�����Ԫ���ṩ��
��5��������ͭΪ�뵼����ϣ��������������ڲ����ĸ���ԭ�ӣ�������ԭ��λ�����ĺͶ��㣬��þ���������ͭԭ�ӣ�
��6��������Ϊ�����������壬�侧���߳�a=0.405nm����������ԭ�ӵ���λ��Ϊ �� ��ʽ��ʾ�����ʵ��ܶ�gcm��3�����ؼ�����������
���𰸡�
��1��X����������
��2��1s22s22p63s23p63d5�����������ӵ�3d���Ϊ����״̬�����������ȶ�
��3��sp3��sp2������ķ��Ӽ��������������˷���֮��������
��4����
��5��16
��6��12��![]()
���������⣺��1����������������ߣ�����X������ӷ��֣������X���߷������䣬�Ǿ��岻�������䣬������ڶ���֮�䣬���ͨ��������������ȷ�������Դ��ǣ�X���������䣻��2��26��Ԫ��Fe��̬ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d64s2 �� ʧȥ3�����ӱ�Ϊ������ʱ�����������ӵĵ����Ų�ʽΪ1s22s22p63s23p63d5 �� ��Ϊ���������Ӵ��ڰ������ȶ�״̬���������������ӱȶ��������ӵ��ȶ��Ը��ã����Դ��ǣ�1s22s22p63s23p63d5�����������ӵ�3d���Ϊ����״̬�����������ȶ�����3����ȩ�м��ϵ�C�γ�4���Ҽ����µ��Ӷԣ���˲�ȡsp3�ӻ����ͣ�ȩ���е�C�γ�3���Ҽ���1���м����µ��Ӷԣ���ȡsp2�ӻ����ͣ�������Ӽ���γ��������ȩ�����γ��������������ķе������ȩ�����Դ��ǣ�sp3��sp2������ķ��Ӽ��������������˷���֮�������ã���4�������[Cu��CN��4]2�� �� ͭ�����ṩ�չ����NԪ���ṩ�¶Ե��ӣ��γ���λ�������Դ��ǣ�������5��������ͭ�����������ڲ����ĸ���ԭ�ӣ�������ԭ��λ�����ĺͶ��㣬���ݾ�̯����֪����ԭ������Ϊ4+8�� ![]() +6��
+6�� ![]() =8�����ݻ�ѧʽCu2O��֪�������к���ͭԭ����Ϊ8��2=16��
=8�����ݻ�ѧʽCu2O��֪�������к���ͭԭ����Ϊ8��2=16��
���Դ��ǣ�16����6����Al�����һ��������������������������Alԭ����ͨ�������������������ϣ�����ռ ![]() ��ͨ��һ��������γ�8����������˸þ�������ԭ�ӵ���λ��Ϊ8��3��
��ͨ��һ��������γ�8����������˸þ�������ԭ�ӵ���λ��Ϊ8��3�� ![]() =12��һ��������Alԭ����Ϊ8��
=12��һ��������Alԭ����Ϊ8�� ![]() +6��
+6�� ![]() =4�����Al���ܶȦ�=
=4�����Al���ܶȦ�= ![]() =
= ![]() gcm��3 ��
gcm��3 ��
���Դ��ǣ�12�� ![]() ��
��