题目内容
13.下表是部分短周期元素的原子半径及主要化合价,根据表中信息判断正确的是以下叙述正确的是( )| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | |
| B. | M和T形成的化合物既能与强酸反应又能与强碱反应 | |
| C. | 单质与等浓度的稀盐酸反应的剧烈程度为Q>L | |
| D. | L2+与R2-的核外电子数相等 |
分析 短周期元素,由元素的化合价可知,T、R都有-2价,而R有+6价且原子半径较大,则T为O元素,R为S元素,L、Q均有+2价,处于ⅡA族,原子半径L>Q,则L为Mg、Q为Be,M只有+3价,处于ⅢA族,原子半径大于硫,则M为Al元素.
A.水分子之间存在氢键,沸点高于硫化氢;
B.氧化铝能与酸反应生成相应的盐与水,与碱反应生成相应的盐与水;
C.金属性越强,与酸反应越剧烈;
D.核外电子数=质子数-离子带的电荷.
解答 解:短周期元素,由元素的化合价可知,T、R都有-2价,而R有+6价且原子半径较大,则T为O元素,R为S元素,L、Q均有+2价,处于ⅡA族,原子半径L>Q,则L为Mg、Q为Be,M只有+3价,处于ⅢA族,原子半径大于硫,则M为Al元素.
A.水分子之间存在氢键,硫化氢分子之间为范德华力,氢键比较范德华力强,故沸点H2O>H2S,故A错误;
B.M与T形成的化合物是氧化铝,是两性氧化物,故B正确;
C.金属性Mg比Be强,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为L>Q,故C错误;
D.L2+的核外电子数为12-2=10,R2-的核外电子数为16-(-2)=18,不相等,故D错误.
故选B.
点评 本题考查结构性质位置关系应用,利用原子半径及化合价来推断出元素是解答本题的关键,并熟悉元素及其单质、化合物的性质来解答即可,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
3.下列化合物中,既能发生消去反应,又能发生水解反应的是( )
| A. | 氯仿 | B. | 1-氯甲烷 | C. | 乙醇 | D. | 氯乙烷 |
8.根据化学反应的实质是旧键断裂、新键形成的观点,下列变化没有发生化学键断裂的是( )
| A. | 电解水 | B. | 干冰受热直接变成气体 | ||
| C. | HCl溶解于水 | D. | 打雷放电时,O2变成O3 |
4.碱式碳酸铜和氯气都是用途广泛的化工原料.
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl-)制备碱式碳酸铜,其制备过程如下:

已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
①氯酸钠的作用是将Fe2+氧化成Fe3+并最终除去;
②反应A后调节溶液的pH范围应为3.2-4.2.
③第一次过滤得到的产品洗涤时,如何判断已经洗净?取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净.
④造成蓝绿色产品中混有CuO杂质的原因是反应B的温度过高.
(2)已知在某温度下Fe(OH)3的容度积常数Ksp=[Fe(OH)3]=1.0×10-38,已知在该温度下溶液中Fe3+离子浓度小于1×10-5mol/L时,该离子已沉淀完全.则该沉淀完全所需要的pH为3.3.
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl-)制备碱式碳酸铜,其制备过程如下:

已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
②反应A后调节溶液的pH范围应为3.2-4.2.
③第一次过滤得到的产品洗涤时,如何判断已经洗净?取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净.
④造成蓝绿色产品中混有CuO杂质的原因是反应B的温度过高.
(2)已知在某温度下Fe(OH)3的容度积常数Ksp=[Fe(OH)3]=1.0×10-38,已知在该温度下溶液中Fe3+离子浓度小于1×10-5mol/L时,该离子已沉淀完全.则该沉淀完全所需要的pH为3.3.
1.在等温、等容条件下,有下列气体反应:2A(g)+2B(g)?C(g)+3D(g).现分别从两条途径建立平衡:Ⅰ.A和B的起始浓度均为2mol/L;Ⅱ.C和D的起始浓度分别为2mol/L和6mol/L.下列叙述正确的是( )
| A. | 达到平衡时,Ⅰ途径的反应速率V(A)等于Ⅱ途径的反应速率V(A) | |
| B. | 达到平衡时,第Ⅰ条途径混合气体的密度与第Ⅱ条途径混合气体的密度相同 | |
| C. | Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数相同 | |
| D. | Ⅰ和Ⅱ两途径最终达到平衡时,体系内混合气体的体积分数不同 |
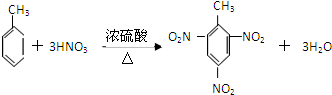 .
.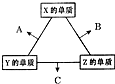 X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16.在适当条件下三种单质两两化合,可发生如图所示变化.己知1个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.请回答下列问题:由 X、Y、Z三种元素共同组成的三种不同种类化合物的化学式为HNO3、NH4NO3、NH3.H2O.
X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16.在适当条件下三种单质两两化合,可发生如图所示变化.己知1个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.请回答下列问题:由 X、Y、Z三种元素共同组成的三种不同种类化合物的化学式为HNO3、NH4NO3、NH3.H2O.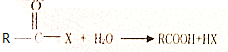
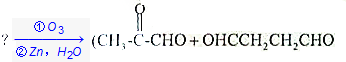

 .
.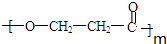 +(m-1)H2O.②B-C、C-E的反应类型分别为:加成反应、缩聚反应.
+(m-1)H2O.②B-C、C-E的反应类型分别为:加成反应、缩聚反应.