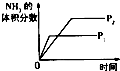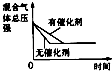题目内容
【题目】NA表示阿伏伽德罗常数,下列叙述正确的是( )
①NaHSO4晶体中阳离子和阴离子的数目比为1:1
②22.4LCH4与18gH2O所含有的电子数均为10NA
③1molSiO2晶体中含NA个SiO2分子
④标准状况下,2.24LCCl4含有的共价键数为0.4NA
⑤20gD2O和18gH2O中含有的质子数均为10NA
⑥在K35ClO3+6H37Cl===KCl+3Cl2↑+3H2O中,若生成71gCl2,则转移的电子数目为![]() NA
NA
⑦在含1mol硅原子的二氧化硅晶体中含有4NA个Si—O键
A. ①②③④⑤⑦ B. ①⑤⑥⑦ C. ①⑤⑦ D. ④⑤⑥⑦
【答案】C
【解析】此类题涉及面广、物质多、微粒种类多、已知条件多,还涉及到物质的状态等,要仔细认真分析每一个叙述,最终确定答案。
①NaHSO4晶体是由Na+和HSO4-构成的盐,所以阳离子和阴离子的数目比为1:1,即①正确;②22.4LCH4因没有指明温度压强,则无法计算其物质的量,故②不正确;③SiO2晶体是由Si原子和O原子通过共价键形成的原子晶体,其中没有SiO2分子,所以③不正确;④标准状况下,CCl4是液体,已知体积,但没有密度,无法计算其物质的量,故④不正确;⑤20gD2O和18gH2O的物质的量都是1mol,则含有的质子数都是10NA,即⑤正确;⑥根据化合价归中原则,反应方程式中生成的3molCl2是由1mol35Cl和5mol37Cl构成,则Cl2的平均摩尔质量73.3g/mol,所以生成71g这种氯气的物质的量小于1mol,则转移的电子小于![]() NA,故⑥不正确;⑦SiO2晶体中,1molSi原子可形成4molSi—O键,所以⑦正确。本题正确的有①⑤⑦,因此本题答案为C。
NA,故⑥不正确;⑦SiO2晶体中,1molSi原子可形成4molSi—O键,所以⑦正确。本题正确的有①⑤⑦,因此本题答案为C。

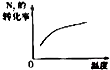
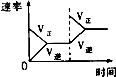
【题目】对于可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|
A.A
B.B
C.C
D.D
【题目】反应mA(g)+nB(g) ![]() pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
压强/Pa | 2×105 | 5×105 | 1×106 |
c(A)/(mol·L-1) | 0.08 | 0.20 | 0.44 |
分析表中数据,回答:
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡(填“向左”“向右”或“不”)移动,理由是。
(2)当压强从5×105 Pa增加到1×106 Pa时,该反应的化学平衡移动,判断的依据是 , 可能的原因是。