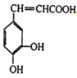
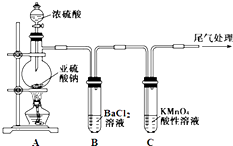
��Ŀ����
����Ŀ�������������壨FeSO47H2O����ҽҩ������Ѫ����ij����С��ⶨ�ò�Ѫ������Ԫ�صĺ�����������ò�Ѫ���Ƿ���ʣ�ʵ�鲽�����£� 
��ش��������⣺
��1���������Һ�еμ�KSCN��Һ����Һ��Ϊ��ɫ�������Һ�к����������ӷ��ţ���������Һ�л�����Fe2+�ķ���Ϊ��ע���Լ�������
��2������ڼ������H2O2��Ŀ���� ��
��3��������з�Ӧ�����ӷ���ʽΪ ��
��4���������һϵ�д����IJ���������������ˡ������ա���������
��5����ʵ������ģ���ÿƬ��Ѫ������Ԫ�ص�����Ϊg��
���𰸡�
��1��Fe3+��ȡһ������Һ���μ�����KMnO4��Һ��KMnO4��Һ��ɫ
��2����Fe2+ȫ������ΪFe3+
��3��Fe3++3NH3?H2O�TFe��OH��3+3NH4+
��4��ϴ�ӣ���ȴ
��5��0.07a
���������⣺������ͼ��֪����ʵ��ԭ��Ϊ����ҩƷ�е�Fe2+�γ���Һ����Fe2+����ΪFe3+ �� ʹFe3+ת��Ϊ����������������ת��Ϊ��������ͨ���ⶨ�����������������㲹Ѫ������Ԫ�صĺ�������1���������ӵ���Һ�еμ�KSCN��Һ����Ϊ��ɫ������������ʹ���������ɫ�����������Ӳ����ԣ��ʴ�Ϊ��Fe3+��ȡһ������Һ���μ�����KMnO4��Һ��KMnO4��Һ��ɫ����2��˫��ˮ���������ԣ������������ܽ�Fe2+ȫ������ΪFe3+ �� �ʴ�Ϊ����Fe2+ȫ������ΪFe3+����3��������ǽ�Fe3+ת��Ϊ����������������Ӧ���ӷ���ʽΪFe3++3NH3H2O=Fe��OH��3��+3NH4+ ��
�ʴ�Ϊ��Fe3++3NH3H2O=Fe��OH��3��+3NH4+����4���������һϵ�д�������������������Һ����ת��Ϊ����������Ҫ���ˡ�ϴ�ӵ�����������Ȼ��������������������ȴ�������������������
�ʴ�Ϊ��ϴ�ӣ���ȴ����5��ag����������Ԫ�ص�������Ϊ10Ƭ��Ѫ������������������ÿƬ��Ѫ������Ԫ�ص����� ![]() =0.07ag��
=0.07ag��
�ʴ�Ϊ��0.07a��
������ͼ��֪����ʵ��ԭ��Ϊ����ҩƷ�е�Fe2+�γ���Һ����Fe2+����ΪFe3+ �� ʹFe3+ת��Ϊ����������������ת��Ϊ��������ͨ���ⶨ�����������������㲹Ѫ������Ԫ�صĺ�������1���������ӵ���Һ�еμ�KSCN��Һ����Ϊ��ɫ�������������Ӻ������ӵ����ʲ������ش𣻣�2��˫��ˮ���������ԣ������������ܽ�Fe2+ȫ������ΪFe3+ �� ������ͼ��֪������H2O2�ǽ�Fe2+����ΪFe3+����3��������ǽ�Fe3+ת��Ϊ����������������4���������һϵ�д�������������������Һ����ת��Ϊ����������Ҫ���ˡ�ϴ�ӵ�����������Ȼ��������������������ȴ���������������������5��������Ԫ���غ��֪ag����������Ԫ�ص�������Ϊ10Ƭ��Ѫ���������������ݴ˼��㣮