题目内容
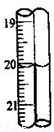
将19.6g铁粉和8g硫粉混合后,放入密闭容器中加热充分反应后冷却,再加入250mL一定物质的量浓度的盐酸,恰好完全反应,试求:
(1)反应后生成的气体是什么?标准状况时体积是多少升?
(2)所加盐酸的物质的量浓度是多少?
解析:
|
解:设8g S与Fe反应生成FeS需x g Fe,则有: Fe + S 56g 32g 1mol x g 8g x= 故Fe过量19.6-14=5.6g,即0.1mol可生成FeS FeS + 2HCl= FeCl2 + H2S↑ Fe + 2HCl= FeCl2+ H2↑ 0.1mol 0.2mol 0.1mol 有(1)反应后生成的气体有H2S与H2, V(H2S)= V(H2)=0.1mol×22.4L/mol=2.24L, V总=5.6L+2.24L=7.84L. (2)所加盐酸的物质的量浓度= =2.8mol·L-1 答:略. |

已知在763K 3.04×104KPa时,用CO和H2为原料合成甲醇CH3OH,存在下列平衡:CO(g)+2H2(g)![]() CH3OH(g),当原料中CO和H2的比例不同时,对CO的转化率及平衡混合气体中甲醇的体积分数都有影响,完成下列各题。
CH3OH(g),当原料中CO和H2的比例不同时,对CO的转化率及平衡混合气体中甲醇的体积分数都有影响,完成下列各题。
(1)设H2和CO的起始物质的量之比为m,平衡时CO的转化率为a,平衡混合物中甲醇的体积分数为y,试推断y、a、m三者的相互关系,并用y=f(a?m)的函数表达式表示出来_________________
(2)将表中的已知数据代入表达式中,把计算结果填入空格中
| m | a | y |
| 1 | 0.25 | |
| 2 | 0.45 | |
| 3 | 19.35% |
(3)根据表中韵数据,判断用CO和H2合成甲醇时,的最焦体积比是少?______________ 并简述其依据:_______________________________________________。
 FeS
FeS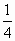 mol
mol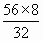 =14<19.6
=14<19.6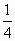 mol,所以加热后的固体为FeS与Fe的混合物,加盐酸后有:
mol,所以加热后的固体为FeS与Fe的混合物,加盐酸后有: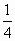 mol
mol 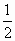 mol
mol 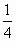 mol×22.4L/mol=5.6L,
mol×22.4L/mol=5.6L,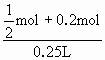
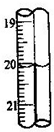 (2012?长宁区二模)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(2012?长宁区二模)三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验: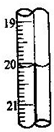 三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]?xH2O)是一种光敏材料,可用于摄影和蓝色印刷.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验: