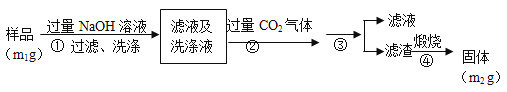
题目内容
【题目】CO和H2的混合气体共3 g,与足量的过氧化钠置于密闭容器中,通入足量氧气用电火花点燃,则固体的质量增加了
A. 3 g B. 3.2 g
C. 4.4 g D. 5.6 g
【答案】A
【解析】CO与氧气反应:2CO+O2 ![]() 2CO2,二氧化碳与过氧化钠反应:2CO2+2Na2O2=2Na2CO3+O2,总方程式为2CO+2Na2O2=2Na2CO3,固体增加的质量为CO的质量,氢气与氧气反应:2H2+O2
2CO2,二氧化碳与过氧化钠反应:2CO2+2Na2O2=2Na2CO3+O2,总方程式为2CO+2Na2O2=2Na2CO3,固体增加的质量为CO的质量,氢气与氧气反应:2H2+O2 ![]() 2H2O,Na2O2与H2O反应:2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,固体增加的质量为氢气质量,则CO和H2的混合气共3g与足量的Na2O2于密闭容器中,通入氧气用电火花点燃,充分反应后,固体增重质量是3g,故选A。
2H2O,Na2O2与H2O反应:2H2O+2Na2O2=4NaOH+O2,总方程式为:2H2+2Na2O2=4NaOH,固体增加的质量为氢气质量,则CO和H2的混合气共3g与足量的Na2O2于密闭容器中,通入氧气用电火花点燃,充分反应后,固体增重质量是3g,故选A。

【题目】下列各组物质中,Y是X物质中含有的少量杂质,Z是除杂试剂,其中所加试剂最合理的一组是( )
X | Y | Z | |
A | NaHCO3溶液 | Na2CO3 | BaCl2溶液 |
B | FeCl3溶液 | CuCl2 | Fe |
C | Fe2O3 | Al2O3 | NaOH溶液 |
D | Na2SO4溶液 | Na2CO3 | 盐酸 |
A.A
B.B
C.C
D.D
【题目】X、T、Y、Z为1﹣36号元素,且原子序数依次增大,四种元素的性质或结构信息如表。请根据信息回答下列问题。
元素 | T | X | Y | Z |
性质结构信息 | 人体内含量最多的元素,且其单质是最常见的助燃剂。 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质性质稳定,但其原子较活泼。 | 第3周期元素的简单离子中半径最小。 | 第4周期元素,M电子层为全充满状态,最外层只有一个电子的原子。 |
(1)写出元素T的离子结构示意图______________;写出元素X的气态氢化物的电子式__________;写出Z元素原子的外围电子排布式__________;元素Y的原子核外共有_______种形状不同的电子云。
(2)Y元素原子的第一电离能______镁(填“>”“<”“=”),从结构上分析,其理由是:__________________。
(3)元素T与氟元素相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是_______(填序号字母)。
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.