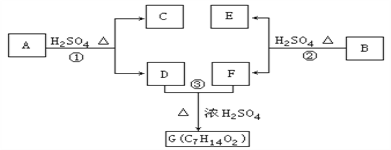
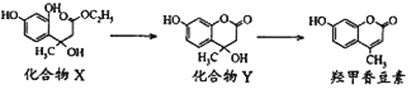
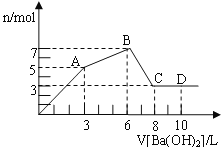
题目内容
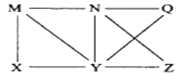
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的.周期数与主族序数相等。
![]()
请回答下列问题:
(1)W在周期表中的位置是____________________________________,Q、R、T三种元素原子半径由大到小的顺序为____________________________________________________________________。(用元素符号表示),QO2的电子式为________________________,R的最高价氧化物的化学式____________________________。
(2)T单质与NaOH 溶液反应的离子方程式为____________________________________________________________________ 。
【答案】)第3周期、第ⅥA族 Al>C>N ![]() N2O5 2Al+2OH-+6H2O = 2 [Al(OH)4]-+3H2↑
N2O5 2Al+2OH-+6H2O = 2 [Al(OH)4]-+3H2↑
【解析】
图中所示是短周期元素Q、R、T、W在元素周期表中的位置,因为T所处的周期序数与主族族序数相等,所以可以知道T是Al,Q是C,R是N,W是S,据此解答各小题即可。
T所处的周期序数与主族族序数相等,则T为Al,结合位置可知:Q是C,R是N,W是S,
(1)W为S,S有3个电子层,最外层6个电子,故处于第三周期ⅥA族,电子层数越多,半径越大,同一周期原子序数越小,半径越大,故C、N、Al三种元素原子的半径从大到小排列顺序Al>C>N,C的最高价氧化物为二氧化碳,CO2中C与O形成两对共价键,故电子式为![]() ,R为N,N最外层有5个电子,最高价氧化物的化学式为N2O5,故答案为:第三周期ⅥA族;Al>C>N;
,R为N,N最外层有5个电子,最高价氧化物的化学式为N2O5,故答案为:第三周期ⅥA族;Al>C>N;![]() ;N2O5;
;N2O5;
(2)T为Al,与氢氧化钠反应的离子方程式为:2Al+2OH-+6H2O = 2 [Al(OH)4]-+3H2↑,故答案为:2Al+2OH-+6H2O = 2 [Al(OH)4]-+3H2↑。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案