题目内容
下列各溶液中,物质的量浓度关系正确的是
| A.0.1 mol?L—1的KAl(SO4)2溶液中:c(SO42—)>c(K+)>c(A13+)>c(H+)>c(OH—) |
| B.10mL0.01mo1?L—1HCl溶液与10mL0.01mo1?L—1Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12 |
| C.在01mo1?L—1CH3COONa溶液中,c(OH—)=c(CH3COOH)+c(H+) |
| D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液,若溶液呈酸性,则有c(Na+)>c(HX)>c(X—)>c(H+)>c(OH—) |
AC
试题分析:A、根据电离方程式、盐类水解、强弱电解质的电离可知,正确;B、酸碱中和时碱过量,则c(OH—)=
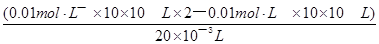 =5×10—3mol?L—1,c(H+)=
=5×10—3mol?L—1,c(H+)=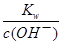 =2×10—12mol?L—1,pH<12,错误;H2O
=2×10—12mol?L—1,pH<12,错误;H2O H++OH—,水电离出的部分H+与CH3COO—结合生成CH3COOH,由质子守恒原理可知,正确;D、违反电荷守恒原理,HX的电离程度大于NaX的水解程度,由物料守恒原理可知,c(X—)>c(Na+)>c(HX)>c(H+)>c(OH—),错误。
H++OH—,水电离出的部分H+与CH3COO—结合生成CH3COOH,由质子守恒原理可知,正确;D、违反电荷守恒原理,HX的电离程度大于NaX的水解程度,由物料守恒原理可知,c(X—)>c(Na+)>c(HX)>c(H+)>c(OH—),错误。
练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目

 H++OH? ,请回答:
H++OH? ,请回答: