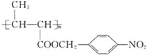
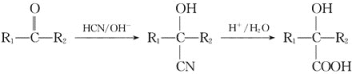
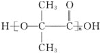
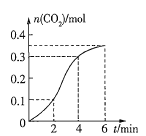
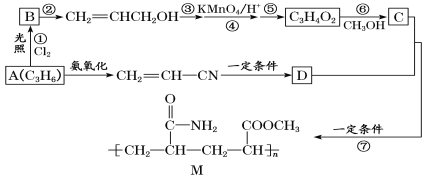
题目内容
【题目】(1)根据原子结构、元素周期表和元素周期律的知识回答下列问题:
①X是1~36号元素原子核外电子排布中未成对电子数最多的元素,X元素的名称是___,在元素周期表中的位置是___,位于周期表___区。。
②C、N、O、F四种元素第一电离能由大到小的顺序为___。
(2)早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
①基态铜原子的电子排布式为___。
②CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是___;Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___个铜原子。
【答案】铬 第四周期第ⅥB族 d区 FNOC [Ar]3d104s1 Cu2O中Cu+电子排布为[Ar]3d10,3d轨道全充满,较稳定;而CuO中Cu2+中3d轨道排布为3d9,不稳定 16
【解析】
要寻找1~36号元素原子核外电子排布中未成对电子数最多,只要找到3d轨道和4s轨道呈半满状态的元素即可;同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但氮的价电子式为2s22p3呈半充满状态,第一电离能大于相邻元素;铜为29号元素。
(1)①根据核外电子的排布式可知,3d轨道和4s轨道呈半满状态的元素为铬,则铬是1~36号元素原子核外电子排布中未成对电子数最多的元素;铬元素位于第四周期第ⅥB族,处于元素周期表的d区。
②同一周期中,元素的第一电离能随着原子相等的增大而呈增大趋势,但氮的价电子式为2s22p3呈半满状态,第一电离能大于相邻元素,所以四种元素的第一电离能大小顺序是F>N>O>C。
(2)①铜为29号元素,核外电子数为29,因全充满或半充满状态是稳定的,故基态铜原子的电子排布式为[Ar]3d104s1。
②Cu2O中铜元素显+1价,Cu+电子排布为[Ar]3d10,3d轨道全充满,较稳定,CuO中铜元素显+2价,Cu2+电子排布为[Ar]3d9,不稳定,故Cu2O比CuO更稳定;Cu2O的立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则晶胞中氧原子的个数为![]() ,铜原子与氧原子的个数比为2:1,则该晶胞中有16个铜原子。
,铜原子与氧原子的个数比为2:1,则该晶胞中有16个铜原子。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(1)某元素原子共有3个价电子,其中一个价电子位于第三能层![]() 能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
(2)![]() 、
、![]() 均为短周期金属元素。依据下表数据,写出
均为短周期金属元素。依据下表数据,写出![]() 原子的核外电子排布式:______。
原子的核外电子排布式:______。
电离能/ |
|
|
|
|
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |