题目内容
Ⅰ.合成氨工业对国民经济和社会发展具有重要的意义.其原理为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol据此回答以下问题:
(1)为了提高氨气的产率,可以选择的方法是________(填序号,错选扣分).
①升高温度
②增大压强
③使用催化剂
④及时分离出NH3
(2)对在密闭容器中进行的可逆反应:N2(g)+3H2(g)![]() 2NH3(g),下列哪种情况下,说明该反应已经达到化学平衡状态________.
2NH3(g),下列哪种情况下,说明该反应已经达到化学平衡状态________.
①N2的正反应速率是NH3的逆反应速率的1/2
②在恒容条件下,混合气体的压强保持不变
③N2、H2、NH3的物质的量之比为1∶3∶2
④单位时间内每生成3 mol H2的同时有2 mol NH3生成
⑤3 mol N-N键断裂,同时有6 mol N-H键断裂
(3)一定条件下,NH3在固定体积的密闭容器中发生分解反应(ΔH>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是________(选填序号).

Ⅱ.(1)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3-+5SO32-+2H+生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如下表所示:

该实验的目的是________;表中V1=________mL.
(2)可逆反应C(s)+H2O(g)![]() H2(g)+CO(g),ΔH>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如下图.
H2(g)+CO(g),ΔH>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如下图.

①图中t4到t6段时引起平衡移动的条件可能是________;
②图中表示平衡混合物中CO的含量最高的一段时间是________.
解析:
|
Ⅰ.(1)②④ (2)①②④ (3)C Ⅱ.(1)探究该反应速率与亚硫酸钠溶液浓度的关系,探究该反应速率与温度的关系 10 (2)①增大压强 ②t3-t4 |

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案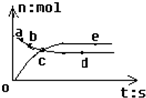 合成氨工业对国民经济和社会发展具有重要意义.对于密闭容器中的N2(g)+3H2(g)
合成氨工业对国民经济和社会发展具有重要意义.对于密闭容器中的N2(g)+3H2(g) 2NH3(g),在673K 30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
2NH3(g),在673K 30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( ) 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)+Q,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是( )
| A、点a的正反应速率比点b的小 | B、点 c处反应达到平衡 | C、点d(t1时刻) 和点 e(t2时刻) 处n(N2)不一样 | D、其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大 |
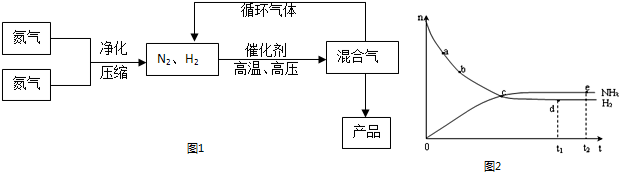
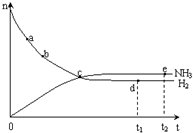 合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为:
合成氨工业对国民经济和社会发展具有重要的意义. 合成塔中发生反应为: