��Ŀ����
 �ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮 �ϳ����з�����ӦΪ��
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮 �ϳ����з�����ӦΪ��N2��g��+3H2��g��?2NH3��g����H��0
��1����ҵ����ʱ����ȡ������һ����ӦΪ��CO��g��+H2O��g��?CO2��g��+H2��g����H��0
��t��ʱ����1L�ܱ������г���0.2mol CO��0.3molˮ��������Ӧ����ƽ�����ϵ��c��H2��=0.12mol?L-1�����¶��´˷�Ӧ��ƽ�ⳣ��K=
1
1
���ڱ����¶Ȳ��䣬������ƽ����ϵ���ټ���0.1mol CO������Ӧ���½���ƽ��ʱ��ˮ��������ת���ʦ� ��H2O��
50%
50%
����2���±�Ϊ��ͬ�¶��ºϳɰ���Ӧ��ƽ�ⳣ�����ɱ�����֪T1
��
��
573K�����������������=������| T/K | T1 | 573 | T2 |
| K | 1.00��107 | 2.45��105 | 1.88��103 |
ACD
ACD
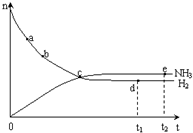
��A��c���ʾn��NH3����n ��H2�����
B��c���ʾNH3����������NH3�ֽ�������ͬ
C��e���d��ʱ��Ӧ��ƽ�ⳣ����ͬ
D��c��ʱ����Ӧ���ʴ����淴Ӧ����
��4����NO2����ˮ�����3NO2+H2O?2HNO3+NO�����������̿�������������Ҫ�����������ԭ���û�ѧƽ���ƶ������۽��н�����
���������NOת��ΪNO2������NO��Ũ�ȣ�����NO2��Ũ�ȣ�ƽ��������Ӧ�ƶ������������ԭ��������
���������NOת��ΪNO2������NO��Ũ�ȣ�����NO2��Ũ�ȣ�ƽ��������Ӧ�ƶ������������ԭ��������
����5�����᳧��β�����е��������������ֱ���ŷŽ���Ⱦ������Ŀǰ��ѧ��̽������ȼ�������еļ���Ƚ��������ﻹԭΪ������ˮ���䷴Ӧ����Ϊ��
CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g������H=-574kJ?mol-1
CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g������H=-1160kJ?mol-1
�����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ��
CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����H=-867kJ/mol
CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����H=-867kJ/mol
����������1������������ʽ�����ƽ��ʱ�����ʵ�����ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽ���㣮
�ڱ����¶Ȳ��䣬ƽ�ⳣ�����䣮������ƽ����ϵ���ټ���0.1mol CO�����Ե�ЧΪ��ʼ����0.3molCO��0.3molH2O��
��μӷ�Ӧ��ˮ�����ʵ���Ϊxmol����������ʽ��x��ʾ�������ʵ�Ũ�ȱ仯����ƽ��ʱ�����ʵ�ƽ��Ũ�ȣ�����ƽ�ⳣ������xֵ��������ת���ʶ�����㣮
��2���ϳɰ�����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ���淴Ӧ���У�ƽ�ⳣ����С�����¶�Խ��ƽ�ⳣ��ԽС��
��3��A����ͼ��֪c��n��NH3����n ��H2����ȣ�
B����ͼ��֪c��������ʵ����������������ʵ�����С��c��δ����ƽ��״̬��ƽ��������Ӧ���У�
C��ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶���ͬ��ƽ�ⳣ����ͬ��
D����ͼ��֪c��������ʵ����������������ʵ�����С��c��δ����ƽ��״̬��ƽ��������Ӧ���У�
��4�����������NOת��ΪNO2������NO��Ũ�ȣ�����NO2��Ũ�ȣ�ƽ��������Ӧ�ƶ������������ԭ�������ʣ�
��5�����ݸ�˹���������Ȼ�ѧ����ʽ�Ӽ�����Ŀ���Ȼ�ѧ����ʽ��
�ڱ����¶Ȳ��䣬ƽ�ⳣ�����䣮������ƽ����ϵ���ټ���0.1mol CO�����Ե�ЧΪ��ʼ����0.3molCO��0.3molH2O��
��μӷ�Ӧ��ˮ�����ʵ���Ϊxmol����������ʽ��x��ʾ�������ʵ�Ũ�ȱ仯����ƽ��ʱ�����ʵ�ƽ��Ũ�ȣ�����ƽ�ⳣ������xֵ��������ת���ʶ�����㣮
��2���ϳɰ�����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ���淴Ӧ���У�ƽ�ⳣ����С�����¶�Խ��ƽ�ⳣ��ԽС��
��3��A����ͼ��֪c��n��NH3����n ��H2����ȣ�
B����ͼ��֪c��������ʵ����������������ʵ�����С��c��δ����ƽ��״̬��ƽ��������Ӧ���У�
C��ƽ�ⳣ��ֻ���¶�Ӱ�죬�¶���ͬ��ƽ�ⳣ����ͬ��
D����ͼ��֪c��������ʵ����������������ʵ�����С��c��δ����ƽ��״̬��ƽ��������Ӧ���У�
��4�����������NOת��ΪNO2������NO��Ũ�ȣ�����NO2��Ũ�ȣ�ƽ��������Ӧ�ƶ������������ԭ�������ʣ�
��5�����ݸ�˹���������Ȼ�ѧ����ʽ�Ӽ�����Ŀ���Ȼ�ѧ����ʽ��
����⣺��1���ٶ��ڿ��淴Ӧ��CO��g��+H2O��g�� CO2��g��+H2��g��
CO2��g��+H2��g��
��ʼ���ʵ���Ũ�ȣ�mol/L�� 0.2 0.3 0 0
ת�����ʵ���Ũ�ȣ�mol/L�� 0.12 0.12 0.12 0.12
ƽ�����ʵ���Ũ�ȣ�mol/L�� 0.08 0.18 0.12 0.12
���Ը��¶��´˷�Ӧ��ƽ�ⳣ��K=
=1��
�ʴ�Ϊ��1��
�ڱ����¶Ȳ��䣬ƽ�ⳣ�����䣬������ƽ����ϵ���ټ���0.1mol CO�����Ե�ЧΪ��ʼ����0.3molCO��0.3molH2O��
���ڿ��淴Ӧ��CO��g��+H2O��g�� CO2��g��+H2��g��
CO2��g��+H2��g��
��ʼ���ʵ���Ũ�ȣ�mol/L�� 0.3 0.3 0 0
ת�����ʵ���Ũ�ȣ�mol/L�� x x x x
ƽ�����ʵ���Ũ�ȣ�mol/L�� 0.3-x 0.3-x x x
����
=1�����x=1.5
���Ե���Ӧ���½���ƽ��ʱ��ˮ��������ת���ʦ���H2O��=
��100%=50%��
�ʴ�Ϊ��50%
��2���ϳɰ�����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ���淴Ӧ���У�ƽ�ⳣ����С�����¶�Խ��ƽ�ⳣ��ԽС���ɱ������ݿ�֪
T1 ʱƽ�ⳣ������573Kʱƽ�ⳣ������T1��573K��
�ʴ�Ϊ������
��3��A����ͼ��֪c��n��NH3����n ��H2����ȣ���A��ȷ��
B����ͼ��֪c��������ʵ����������������ʵ�����С��c��δ����ƽ��״̬��ƽ��������Ӧ���У�c���ʾNH3�������ʴ���NH3�ֽ����ʣ���B����
C���¶���ͬ��ƽ�ⳣ����ͬ��e���d��ʱ��Ӧ��ƽ�ⳣ����ͬ����C��ȷ��
D����ͼ��֪c��������ʵ����������������ʵ�����С��c��δ����ƽ��״̬��ƽ��������Ӧ���У�c��ʱ����Ӧ���ʴ����淴Ӧ���ʣ���D��ȷ��
��ѡ��ACD��
��4�����������NOת��ΪNO2������NO��Ũ�ȣ�����NO2��Ũ�ȣ�ƽ��������Ӧ�ƶ������������ԭ�������ʣ�
�ʴ�Ϊ�����������NOת��ΪNO2������NO��Ũ�ȣ�����NO2��Ũ�ȣ�ƽ��������Ӧ�ƶ������������ԭ�������ʣ�
��5����֪����CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g������H=-574kJ?mol-1
��CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g������H=-1160kJ?mol-1
�ɸ�˹���ɿ�֪����+�ڵã�CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����H=-1734kJ/mol
��CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����H=-867kJ/mol��
�ʴ�Ϊ��CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����H=-867kJ/mol��
 CO2��g��+H2��g��
CO2��g��+H2��g����ʼ���ʵ���Ũ�ȣ�mol/L�� 0.2 0.3 0 0
ת�����ʵ���Ũ�ȣ�mol/L�� 0.12 0.12 0.12 0.12
ƽ�����ʵ���Ũ�ȣ�mol/L�� 0.08 0.18 0.12 0.12
���Ը��¶��´˷�Ӧ��ƽ�ⳣ��K=
| 0.12��0.12 |
| 0.08��0.18 |
�ʴ�Ϊ��1��
�ڱ����¶Ȳ��䣬ƽ�ⳣ�����䣬������ƽ����ϵ���ټ���0.1mol CO�����Ե�ЧΪ��ʼ����0.3molCO��0.3molH2O��
���ڿ��淴Ӧ��CO��g��+H2O��g��
 CO2��g��+H2��g��
CO2��g��+H2��g����ʼ���ʵ���Ũ�ȣ�mol/L�� 0.3 0.3 0 0
ת�����ʵ���Ũ�ȣ�mol/L�� x x x x
ƽ�����ʵ���Ũ�ȣ�mol/L�� 0.3-x 0.3-x x x
����
| x?x |
| (0.3-x)?(0.3-x) |
���Ե���Ӧ���½���ƽ��ʱ��ˮ��������ת���ʦ���H2O��=
| 1.5mol |
| 0.3mol |
�ʴ�Ϊ��50%
��2���ϳɰ�����Ӧ�Ƿ��ȷ�Ӧ�������¶�ƽ���淴Ӧ���У�ƽ�ⳣ����С�����¶�Խ��ƽ�ⳣ��ԽС���ɱ������ݿ�֪
T1 ʱƽ�ⳣ������573Kʱƽ�ⳣ������T1��573K��
�ʴ�Ϊ������
��3��A����ͼ��֪c��n��NH3����n ��H2����ȣ���A��ȷ��
B����ͼ��֪c��������ʵ����������������ʵ�����С��c��δ����ƽ��״̬��ƽ��������Ӧ���У�c���ʾNH3�������ʴ���NH3�ֽ����ʣ���B����
C���¶���ͬ��ƽ�ⳣ����ͬ��e���d��ʱ��Ӧ��ƽ�ⳣ����ͬ����C��ȷ��
D����ͼ��֪c��������ʵ����������������ʵ�����С��c��δ����ƽ��״̬��ƽ��������Ӧ���У�c��ʱ����Ӧ���ʴ����淴Ӧ���ʣ���D��ȷ��
��ѡ��ACD��
��4�����������NOת��ΪNO2������NO��Ũ�ȣ�����NO2��Ũ�ȣ�ƽ��������Ӧ�ƶ������������ԭ�������ʣ�
�ʴ�Ϊ�����������NOת��ΪNO2������NO��Ũ�ȣ�����NO2��Ũ�ȣ�ƽ��������Ӧ�ƶ������������ԭ�������ʣ�
��5����֪����CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g������H=-574kJ?mol-1
��CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g������H=-1160kJ?mol-1
�ɸ�˹���ɿ�֪����+�ڵã�CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����H=-1734kJ/mol
��CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����H=-867kJ/mol��
�ʴ�Ϊ��CH4��g��+2NO2��g��=CO2��g��+2H2O��g��+N2��g����H=-867kJ/mol��
����������ƽ�ⳣ���ļ������ü�Ӱ�����ء�ƽ���ƶ����Ȼ�ѧ����ʽ�ȣ��Ѷ��еȣ�ע��ƽ�ⳣ���ļ��㼰����ʽ���ⷨ�����ã�

��ϰ��ϵ�д�
�����Ŀ
 �ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��
 �ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��N2��g��+3H2��g��
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��N2��g��+3H2��g��  2NH3��g��������ӦΪ���ȷ�Ӧ����673K��30MPa�£�n��NH3����n��H2����ʱ�� t�仯�Ĺ�ϵ��ͼ��ʾ�����������У���ȷ���ǣ�������
2NH3��g��������ӦΪ���ȷ�Ӧ����673K��30MPa�£�n��NH3����n��H2����ʱ�� t�仯�Ĺ�ϵ��ͼ��ʾ�����������У���ȷ���ǣ�������
 �ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��N2��g��+3H2��g��
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壮�����ܱ������еķ�Ӧ��N2��g��+3H2��g��