题目内容
1.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 6.2 g白磷(P4)中所含P-P键的数目为0.15NA(白磷分子结构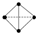 ) ) | |
| B. | 常温常压下,16 g 14CH4所含中子数为8NA | |
| C. | 117 g氯化钠固体中含有2NA个氯化钠分子 | |
| D. | 含5NA个电子的氨气中,氢原子数目为1.5NA |
分析 A.根据1molP4分子含有6molP-P键计算出6.2g白磷中含有的P-P键数目;
B.14CH4的摩尔质量为18g/mol,其分子中含有10个中子;
C.氯化钠为离子化合物,不存在氯化钠分子;
D.氨气分子中含有10个电子,含5NA个电子的氨气的物质的量为0.5mol,含有1.5mol氢原子.
解答 解:A.6.2g白磷含有P4的物质的量为:$\frac{6.2g}{124g/mol}$=0.05mol,0.05molP4分子中含有P-P键的物质的量为:0.05mol×6=0.3mol,所含P-键数目为0.3NA,故A错误;
B.16 g 14CH4的物质的量为:$\frac{16g}{18g/mol}$=$\frac{8}{9}$mol,含有中子数为:$\frac{8}{9}$mol×10=8$\frac{8}{9}$mol,所含中子数为8$\frac{8}{9}$molNA,故B错误;
C.氯化钠晶体为离子晶体,不存在NaCl分子,故C错误;
D.含5NA个电子的氨气的物质的量为0.5mol,0.5mol氨气中含有1.5mol氢原子,含有的氢原子数目为1.5NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
11.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1 mol硫酸钾中阴离子所带电荷数为NA | |
| B. | 常温下,2.7克铝与足量的氢氧化钠溶液反应,失去的电子数为0.1NA | |
| C. | 在常温下,把100 g CaCO3加到1 L水中,所得溶液中的Ca2+数等于NA | |
| D. | 在标准状况下,22.4 L CH4与18 g H2O所含有的分子数均为NA |
12. 在一定温度下,容器内某一反应中,X、Y的物质在量随反应时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,容器内某一反应中,X、Y的物质在量随反应时间变化的曲线如图所示,下列表述中正确的是( )
 在一定温度下,容器内某一反应中,X、Y的物质在量随反应时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,容器内某一反应中,X、Y的物质在量随反应时间变化的曲线如图所示,下列表述中正确的是( )| A. | 反应的化学方程式为:2X?Y | B. | t2时,正逆反应速率相等,达到平衡 | ||
| C. | t1时,Y的浓度是X的2倍 | D. | t3时,正反应速率大于逆反应速率 |
9.实验证明,以下六种物质是一个氧化还原反应的反应物和生成物:NO、FeSO4、H2O、Fe(NO3)3、HNO3和Fe2(SO4)3下列说法错误的是( )
| A. | 该反应中氧化剂只有一种 | |
| B. | 该反应中还原产物只有一种 | |
| C. | 被氧化的元素一定是Fe元素 | |
| D. | 该反应中NO和Fe2(SO4)3的物质的量之比为2:3 |
16.对于由短周期元素构成的离子化合物,且阳离子与阴离子电子数之和为20,下列说法正确的是( )
| A. | 阳离子半径一定大于阴离子半径 | |
| B. | 一定只含离子键不含共价键 | |
| C. | 一定不含第一周期元素 | |
| D. | 阳离子和阴离子个数之比不一定为1:1 |
6.常温下,CaSO4的沉淀溶解平衡曲线如图,Ksp(CaSO4)=9×10-6.下列判断错误的是( )

| A. | a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液 | |
| B. | a点对应的Ksp等于c点对应的Ksp | |
| C. | b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol•L-1 | |
| D. | 向d点溶液中加入适量CaCl2固体可以变到c点 |
13.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,2.24 L H2O中分子的数目为0.1 NA | |
| B. | 0.1 mol•L-1 NH4Cl溶液中含有Cl-的数目为0.1 NA | |
| C. | 常温下,1.7 g NH3中含有氢原子数目为0.3 NA | |
| D. | 5.6 g铁粉在足量的氯气中充分燃烧,转移电子数为0.2 NA |
