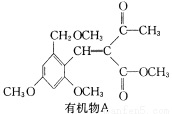
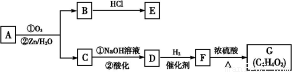
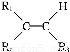
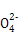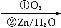题目内容
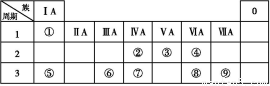
下列说法正确的是( )
A.常温下醋酸分子不可能存在于pH>7的碱性溶液中
B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(N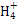 )>c(Cl-)
)>c(Cl-)
C.0.1 mol·L-1的氯化铵溶液与0.05 mol·L-1的氢氧化钠溶液等体积混合后溶液中离子浓度的大小关系是:c(Cl-)>c(N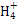 )>c(Na+)>c(OH-)>c(H+)
)>c(Na+)>c(OH-)>c(H+)
D.0.1 mol·L-1硫化钠溶液中离子浓度的关系:c(Na+)=c(S2-)+c(HS-)+c(H2S)
C
【解析】CH3COONa溶液中由于CH3COO-水解显碱性,同时生成CH3COOH,A错;根据溶液电中性,c(N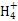 )+c(H+)=c(Cl-)+c(OH-),由溶液的pH=7,可知c(H+)=c(OH-),故c(N
)+c(H+)=c(Cl-)+c(OH-),由溶液的pH=7,可知c(H+)=c(OH-),故c(N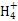 )=c(Cl-),B错;0.1 mol·L-1的氯化铵溶液与0.05 mol·L-1的氢氧化钠溶液等体积混合后得到浓度均为:0.025 mol·L-1的NH4Cl、NH3·H2O、NaCl混合溶液,其中NH3·H2O的电离程度大于NH4Cl的水解程度,故c(Cl-)>c(N
)=c(Cl-),B错;0.1 mol·L-1的氯化铵溶液与0.05 mol·L-1的氢氧化钠溶液等体积混合后得到浓度均为:0.025 mol·L-1的NH4Cl、NH3·H2O、NaCl混合溶液,其中NH3·H2O的电离程度大于NH4Cl的水解程度,故c(Cl-)>c(N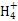 )>c(Na+)>c(OH-)>c(H+),C对;根据物料守恒,硫化钠溶液中存在:c(Na+)=2[c(S2-)+c(HS-)+c(H2S)],D错。
)>c(Na+)>c(OH-)>c(H+),C对;根据物料守恒,硫化钠溶液中存在:c(Na+)=2[c(S2-)+c(HS-)+c(H2S)],D错。

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目