题目内容
下列实验操作或现象正确的是( )
分析:A、依据分液漏斗的结构和分液操作分析判断,漏斗口密封液体流不出;
B、依据滴定管中气泡的排除方法分析;
C、(NH4)2Fe(SO4)2?6H2O,商品名为摩尔盐,易溶于水,铁元素为+2价,硫酸亚铁铵晶体中的结晶水受热容易失去,蒸干会使晶体分解;
D、依据P2O5(或Al2O3)能使无水乙醇脱水生成乙烯分析;
B、依据滴定管中气泡的排除方法分析;
C、(NH4)2Fe(SO4)2?6H2O,商品名为摩尔盐,易溶于水,铁元素为+2价,硫酸亚铁铵晶体中的结晶水受热容易失去,蒸干会使晶体分解;
D、依据P2O5(或Al2O3)能使无水乙醇脱水生成乙烯分析;
解答:A、将分液漏斗中混合液振荡后放在铁架台的铁圈上静置片刻,将漏斗上口玻璃塞或使塞凹槽(或小孔)对准口小孔;打开旋塞,放出下层液体,故A错误;
B、将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出,从而溶液充满尖嘴,排除气泡,故B正确;
C、将(NH4)2SO4饱和溶液与FeSO4饱和溶液混合后,在蒸发皿中蒸发至大量晶体析出,然后冷却、抽滤得到结晶水合物,不能用蒸馏水洗因为摩尔盐易溶于水,用酒精可以洗去摩尔盐表面的水,然后晾干,故C错误;
D、无水乙醇与P2O5(或Al2O3)混合后,加热将产生乙烯气体,通入溴水发生加成反应褪色,故D错误;
故选B.
B、将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出,从而溶液充满尖嘴,排除气泡,故B正确;
C、将(NH4)2SO4饱和溶液与FeSO4饱和溶液混合后,在蒸发皿中蒸发至大量晶体析出,然后冷却、抽滤得到结晶水合物,不能用蒸馏水洗因为摩尔盐易溶于水,用酒精可以洗去摩尔盐表面的水,然后晾干,故C错误;
D、无水乙醇与P2O5(或Al2O3)混合后,加热将产生乙烯气体,通入溴水发生加成反应褪色,故D错误;
故选B.
点评:本题考查了实验基本操作,物质的性质与制备,熟练掌握基本操作,是做好此类题目的前提.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验操作、现象或反应原理的解释、结论均正确的一组是( )
| 操作、现象 | 解释或结论 |
| A.铝箔在酒精灯火焰上加热,熔化但不滴落 | 铝箔对熔化的铝有吸附作用 |
| B.向盛有0.005mol/L FeCl3溶液的试管中加入5mL 0.01mol/LKSCN溶液,溶液呈红色,再加入5滴饱和FeCl3溶液,红色加深 | 增大反应物的浓度,化学平衡向正反应方向移动 |
| C.证明Mg(OH)2沉淀可以转化为Fe(OH)3 沉淀 |
向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| D.取某溶液少量,加入盐酸酸化的硝酸钡溶液,出现白色沉淀 | 该溶液中一定含有大量的SO42- |
| A、铝箔在酒精灯火焰上加热,熔化但不滴落 |
| B、向盛有0.005mol/L FeCl3溶液的试管中加入5mL 0.01mol/LKSCN溶液,溶液呈红色,再加入5滴饱和FeCl3溶液,红色加深 |
| C、证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
| D、取某溶液少量,加入盐酸酸化的硝酸钡溶液,出现白色沉淀 |
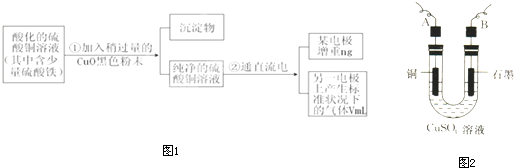

 (4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。
(4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4•5H2O的新工艺。模拟制备装置如下图所示。