题目内容
10.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:①第一份加入AgNO3溶液有沉淀产生
②第二份加足量NaOH溶液加热后,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
试回答下列问题
(1)由实验②可知溶液中含有的离子为NH4+,在100mL溶液中该离子的物质的量浓度为0.4mol/L
(2)由实验③可以判断中溶液中含有的离子为CO32-、SO42-
(3)由上述实验信息判断下列说法中正确的是AC
A.K+一定存在 B.100mL溶液中含0.01mol CO32-C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在.
(4)根据上述实验,该溶液中是否有不能肯定其存在的离子?若有,则为进一步确定其存在,应该补充的实验是取少量原溶液,加入足量Ba(NO3)2溶液后,静置取上层清液加入AgNO3溶液和稀HNO3,如果有沉淀产生说明存在Cl-.
分析 ①加入AgNO3溶液有沉淀产生,说明溶液中可能存在Cl-、CO32-、SO42-;
②0.04mol气体为氨气,溶液中一定含有NH4+,并且物质的量为0.04mol;
③2.33g沉淀为硫酸钡,6.27g沉淀为硫酸钡和碳酸钡的混合物;
再根据电荷守恒,得出一定存在钾离子,据此进行解答.
解答 解:①第一份加入AgNO3溶液有沉淀产生,与AgNO3溶液有沉淀产生的离子有:Cl-、CO32-、SO42-;
②加足量NaOH溶液加热产生气体,气体是氨气,故一定有铵离子0.04mol,溶液中一定含有NH4+,并且物质的量为0.04mol;
③不溶于盐酸的2.33g为硫酸钡,物质的量为:$\frac{2.33g}{233g/mol}$=0.01mol;6.27g沉淀是硫酸钡和碳酸钡,碳酸钡质量为6.27g-2.33g=3.94g,碳酸钡的物质的量为:$\frac{3.94g}{197g/mol}$=0.02mol,故原溶液中一定存在CO32-、SO42-,则一定没有Mg2+、Ba2+;
再根据电荷守恒,正电荷为:n(+)=n(NH4+)=0.04mol;c(-)=2c(CO32-)+2c(SO42-)=0.06mol,正电荷总物质的量大于负电荷,故原溶液中一定有K+,至少为0.02mol;
综合以上可以得出,一定存在的离子有:NH4+、K+、CO32-、SO42-,一定没有的离子Mg2+、Ba2+,可能存在Cl-,
(1)由实验②可知溶液中含有0.04molNH4+,在100mL溶液中该离子的物质的量浓度为:$\frac{0.04mol}{0.1L}$=0.4mol/L,
故答案为:NH4+;0.4mol/L;
(2)由实验③可以判断中溶液中一定存在CO32-、SO42-,则一定没有Mg2+、Ba2+,
故答案为:CO32-、SO42-;
(3)A.根据分析可知,溶液中一定存在K+,故A正确;
B.100mL溶液中含0.02mol CO32-,故B错误;
C.溶液中可能含有Cl-,故C正确;
D.溶液中一定没有Mg2+、Ba2+,故D错误;
故答案为:AC;
(4)溶液中可能含有氯离子,检验原溶液中是否含有氯离子的操作方法为:取少量原溶液,加入足量Ba(NO3)2溶液后,静置取上层清液加入AgNO3溶液和稀HNO3,如果有沉淀产生说明存在Cl-,
故答案为:取少量原溶液,加入足量Ba(NO3)2溶液后,静置取上层清液加入AgNO3溶液和稀HNO3,如果有沉淀产生说明存在Cl-.
点评 本题考查常见离子的检验方法,题目难度中等,注意掌握常见离子的化学性质及检验方法,本题中根据电荷守恒判断钾离子的存在为易错点,做题时需要细致分析.

| A. | S(s)+O2(g)═SO2(g),生成1mol SO2(g),反应放出的热量小于293.23 kJ | |
| B. | S(g)+O2(g)═SO2(g),生成1mol SO2(g),反应放出的热量大于293.23 kJ | |
| C. | 1 mol SO2的键能的总和大于1 mol 硫和1 mol 氧气的键能之和 | |
| D. | 1 mol SO2的键能的总和小于1 mol 硫和1 mol 氧气的键能之和 |
| A. | 0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| B. | 28 g乙烯分子中含有极性共价键的数目为6NA | |
| C. | 50mL18mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于0.45NA | |
| D. | 足量的铁与0.1molC12充分反应,转移的电子数为0.3NA |
| A. | CH3COOH和Na2CO3与CH3COOH和NaHCO3 | |
| B. | AgNO3和HCl与Ag2SO3和HCl | |
| C. | BaCl2和Na2SO4 与Ba(OH)2与H2SO4 | |
| D. | KOH和CH3COOH与Ba(OH)2与CH3COOH |
| A. | M-3aNA-b | B. | M-3aNA+b | C. | [(M÷NA)-3a-b] | D. | [M÷(3a-b)NA] |

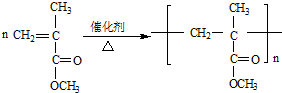 ;
; ”结构的链状化合物共有7种;
”结构的链状化合物共有7种;