题目内容
11.实验室要配制100ml、1mol/L 的NaOH溶液,回答下列问题:(1)经计算,应该用托盘天平称取NaOH固体4.0g;
(2)配制溶液时,一般可分为以下几个步骤:①溶解②称量③计算④定容⑤洗涤⑥转移,其正确的操作顺序为③②①⑥⑤④
(3)①溶解过程中玻璃棒的作用搅拌,⑥转移过程中玻璃棒的作用引流
(4)容量瓶上需标有以下五项中的①温度②浓度③容量④压强⑤刻度线A
A、①③⑤B、①②③C、③④⑤D、②③④
(5)若用NaOH固体配制溶液,下列仪器中不需要用到的是B
A、烧杯 B、蒸发皿 C、胶头滴管 D、药匙 E、托盘天平 F、玻璃棒 G、100ml的容量瓶
(6)下列情况,对所配溶液的浓度有何影响(填偏高、偏低或无影响)未将洗涤烧杯内壁的溶液转入100ml的容量瓶,会使溶液浓度偏低,配制溶液定容时,仰视容量瓶刻度线,会使溶液浓度偏低.
分析 (1)依据m=CVM计算2需要氢氧化钠的质量;
(2)根据溶液配制的操作步骤进行排序,溶液配制步骤:计算→称量→溶解→冷却→转移→洗涤→定容→摇匀;
(3)玻璃棒在溶解时作用为搅拌;在移液时作用为引流;
(4)依据容量瓶构造解答;
(5)根据溶液配制的操作步骤选择合适的仪器;
(6)分析操作对溶质物质的量、溶液体积的影响,根据c=$\frac{n}{V}$判断对所配溶液浓度的影响.
解答 解:(1)配制100ml、1mol/L 的NaOH溶液,需要用托盘天平称取NaOH固体质量m=1mol/L×0.1L×40g/mol=4.0g,故答案为:4.0;
(2)配制一定物质的量浓度溶液步骤:计算→称量→溶解→冷却→转移→洗涤→定容→摇匀,所以正确顺序为③②①⑥⑤④,
故答案为:③②①⑥⑤④;
(3)玻璃棒在溶解时作用为搅拌;在移液时作用为引流,故答案为:搅拌;引流;
(4)容量瓶上标注有:温度、刻度线、容积,故答案为:A;
(5)配制一定物质的量浓度溶液步骤:计算→称量→溶解→冷却→转移→洗涤→定容→摇匀,需要的仪器:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,用不到的仪器:蒸发皿;
故选:B;
(6)未将洗涤烧杯内壁的溶液转入100ml的容量瓶,导致溶质的物质的量偏小,溶液浓度偏低;
配制溶液定容时,仰视容量瓶刻度线,导致溶液体积偏大,溶液浓度偏低;
故答案为:偏低;偏低.
点评 本题考查一定物质的量浓度溶液的配制,明确配制原理和容量瓶构造及使用方法是解题关键,注意误差分析的方法和技巧,题目难度不大.

练习册系列答案
相关题目
1.有机物 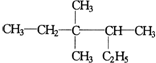 的正确命名为( )
的正确命名为( )
 的正确命名为( )
的正确命名为( )| A. | 2-乙基-3,3-二甲基-4-乙基戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 3,3,4-三甲基已烷 | D. | 2,3,3-三甲基已烷 |
19.下列全球环境问题属于大气污染的危害的是( )
| A. | 全球增温问题,臭氧空洞问题,酸雨问题 | |
| B. | 海洋污染问题,土壤荒漠化问题,物种灭绝 | |
| C. | 森林面积减少,饮用水污染问题,有害废弃物越境迁移 | |
| D. | 饮用水污染问题,土壤荒漠化问题,噪声污染问题 |
6.某温度下,反应2N2O5?4NO2+O2开始进行时,c(N2O5)=0.040 8mol/L.经1min后,c(N2O5)=0.030mol/L.则该反应的反应速率为( )
| A. | v(N2O5)=1.8×10-4 mol/(L•s) | B. | v(N2O5)=1.08×10-2 mol/(L•s) | ||
| C. | v(NO2)=1.8×104 mol/(L•s) | D. | v(O2)=1.8×104 mol/(L•s) |
3.已知ag气体X2中含有b个X原子,那么cg该气体在0℃、1.01×105 Pa条件下的体积是(NA 表示阿伏加德罗常数的值)( )
| A. | $\frac{11.2bc}{a{N}_{A}}$ L | B. | $\frac{11.2ab}{c{N}_{A}}$L | C. | $\frac{11.2ac}{b{N}_{A}}$ L | D. | $\frac{11.2b}{ac{N}_{A}}$L |
20.2015年8月12日天津港瑞海物流危险化学品堆垛发生火灾,并发生爆炸,爆炸造成了巨大的人员伤亡及财产损失.消防员灭火时发现将水浇到化学品电石(CaC2)时引起了更剧烈的爆炸.原因是发生了反应:CaC2+2H2O═Ca(OH)2+C2 H2↑,C2 H2遇明火剧烈燃烧并可能爆炸.下列说法不正确的是( )
| A. | 6.4g CaC2 与水完全反应可产生2.24L C2H2气体 | |
| B. | 实验室保存电石时应注意密封,并置于阴凉干燥处 | |
| C. | 电石与水反应不是氧化还原反应 | |
| D. | 电石是遇湿易燃物品属第4类危险化学品 |
1.已知CN-(氢氰酸根离子)SCN-(硫氰酸根离子)和Cl-有相似之处:两个-CN原子团或两个-SCN原子团可分别构成氰分子(CN)2和硫氰分子(SCN)2.(CN)2和(SCN)2的性质和Cl2有性质有相似之处,且常温常压下是气体,下列物质间反应的化学方程式错误的是( )
| A. | 二氧化锰和HSCN溶液加热反应:MnO2+4HSCN$\frac{\underline{\;\;△\;\;}}{\;}$Mn(SCN)2+(SCN)2↑+2H2O | |
| B. | (CN)2和氢氧化钾溶液反应:(CN)2+2KOH═KCN+KCNO+H2O | |
| C. | 碘晶体投入HCN溶液中:I2+2HCN═2HI+(CN)2 | |
| D. | (SCN)2和水反应:(SCN)2+H2O?HSCN+HSCNO |