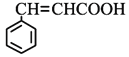题目内容
【题目】锰元素广泛分布在自然界中,其单质和化合物在工农业生产中有着重要的应用。
(1)已知相关热化学方程式为:
4Al(s)+3O2(g)=2Al2O2(s) △H1=a kJmol﹣1
3MnO2(s)=Mn3O4(s)+O2(g) △H2=bkJmol﹣1
3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s) △H3=ckJmol﹣1
则3MnO2(s)+4Al(s)=3Mn(s)+2Al2O3(s) △H=__ kJmol﹣1(用含a、b、c的代数式表示).
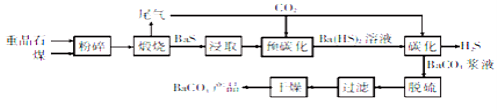
(2)MnCO3广泛用作锰盐原料.通过如图装置焙烧MnCO3可以制取MnO2,反应方程式为:2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)。
①2MnCO3(s)+O2(g)2MnO2(s)+2CO2(g)的化学平衡常数表达式K=______。
②用真空抽气泵不断抽气的目的除保证反应持续进行外,还有______。
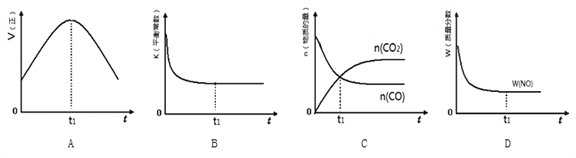
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________(填序号)。(如图中V正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
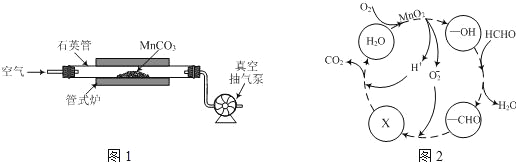
(3)MnO2常用作催化剂。MnO2催化降解甲醛的反应机理如图所示,图中X表示的粒子是______,该反应的总反应方程式为______。
(4)MnSO4是重要微量元素肥料。用惰性电极电解MnSO4溶液可以制得更好活性的MnO2,电解时总反应的离子方程式为:______,电解过程中阴极附近的pH______(选填“增大”、“减小”或“不变”)
【答案】 3/4a+b+1/3c C2(CO2)/(CO2) 使平衡正向移动,提高MnCO3转化率 BD HCO3- HCHO+O2=CO2+H2O Mn2+-2e-+H2O2=MnO2+4H+ 增大
【解析】(1)已知:①.3MnO2(s)=Mn3O4(s)+O2(g)△H1=a kJmol-1
②.3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s)△H2=b kJmol-1
由Al的燃烧热可得:③.Al(s)+![]() O2(g)=
O2(g)=![]() Al2O3(s)△H=-c kJmol-1,
Al2O3(s)△H=-c kJmol-1,
根据盖斯定律,①+![]() ×②+
×②+![]() ×③可得:3MnO2(s)+4Al(s)═3Mn(s)+2Al2O3(s),则△H=(a+
×③可得:3MnO2(s)+4Al(s)═3Mn(s)+2Al2O3(s),则△H=(a+![]() b-
b-![]() c) kJmol-1;
c) kJmol-1;
(2)①2MnCO3(s)+O2(g)![]() 2MnO2(s)+2CO(g)的化学平衡常数表达式K=C2(CO2)/(CO2);
2MnO2(s)+2CO(g)的化学平衡常数表达式K=C2(CO2)/(CO2);
②用真空抽气泵不断抽气,可增大空气量,减少生成物浓度,平衡正向移动,可提高MnCO3的转化率;
③A.t1时正反应速率仍然在变化,说明没有达到平衡状态,故A错误;B.t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,故B正确;C.t1时二氧化碳和氧气的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,故C错误;D.t1时二氧化碳的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,故D正确;故选BD;
(3)氧离子与-CHO转化为X,而X与H+生成CO2和H2O,则X表示的粒子是HCO3-,整个过程是甲醛氧化生成二氧化碳与水,可得该反应的总反应方程式为:HCHO+O2![]() CO2+H2O;
CO2+H2O;
(4)用惰性电极电解酸性MnSO4溶液可制得MnO2,阳极发生氧化反应,Mn2+失去电子转化为MnO2,阴极水得电子发生还原反应生成氢气,总反应离子方程式为:Mn2++2H2O![]() MnO2+H2↑+2H+,阴极附近氢氧根浓度增大,则电解过程中阴极附近的pH增大。
MnO2+H2↑+2H+,阴极附近氢氧根浓度增大,则电解过程中阴极附近的pH增大。

 备战中考寒假系列答案
备战中考寒假系列答案