题目内容
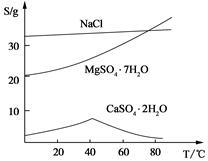
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作。
(1)为检验起始滤液中的Cl-,所用试剂除稀HNO3,还应有
(填化学式)
(2)试剂Ⅰ、Ⅱ、Ⅲ的化学式分别为 、 、
(3)步骤①和②中,所用的玻璃仪器除胶头滴管,还应有
(4)步骤①中,判断试剂Ⅰ已加入过量的方法是:
(5)某同学根据最终所得KCl晶体和原样品的质量求算出氯化钾样品的纯度,你认为其结果是否可靠?并说明理 (不考虑实验误差):
(1)Ba(NO3)2、AgNO3(2分,只答AgNO3不得分)
(2)BaCl2,K 2CO3,HCl (3分)
(3)烧杯、玻璃棒、漏斗(2分)
(4)取少量滤液A加入试剂Ⅰ,若无沉淀,则表明已过量(2分)
(5)不可靠,所得KCl晶体并非完全来自原样品(2分)
解析试题分析:(1)硫酸根离子和碳酸根离子都会干扰氯离子的检验(硫酸银,碳酸银也是白色沉淀),所以先加过量的硝酸钡除去碳酸根离子和硫酸根离子,再加硝酸银如果得到不溶于稀硝酸的白色沉淀就说明含有氯离子。(2)除杂不引杂,引入的杂质还要除去。碳酸钾应放在氯化钡的后面除去多余的钡离子,而盐酸应放在碳酸钾的后面除去多余的碳酸根离子。(3) 步骤①和②属于过滤操作所用的玻璃仪器胶头滴管,
烧杯、玻璃棒、漏斗.(4)如果没有过量再加氯化钡还会有浑浊,否则就没有现象。(5)不可靠,因为氯化钡和碳酸钾中引入了氯离子和钾离子,所以会偏高。
考点:本题考查离子的反应和的除杂及具体的操作及意事项。

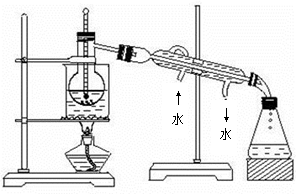
碘元素对人的健康非常重要。下面是从海带灰中分离出单质碘(I2)的流程图。
(1)过程①的实验操作名称是____________,____________。
(2)上述过程中,属于氧化还原反应的是_______,离子方程式为 。
(3)过程③的实验操作名称是___________和___________;在此过程中,可供选择的有
机溶剂是_______(填字母代号)。
| A.酒精 | B.CCl4 | C.苯 | D.醋酸 |
① ;
② ;
③ ;
④ 。(有几处填几处,不必填满,多填扣分。)