题目内容
含AlCl3 13.35g的溶液中加入一定浓度的NaOH溶液100mL后,结果得到沉淀3.9g.(1)写出可能发生反应的离子方程式:______、______;
(2)上述NaOH溶液物质的量浓度可能是多少?(写出计算过程)
【答案】分析:AlCl3和NaOH反应与NaOH的量的多少有关,当NaOH不足时生成Al(OH)3,当碱过量时,则生成NaAlO2.现AlCl3的物质的量为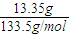 =0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀,根据Al3++3OH-═Al(OH)3↓计算n(NaOH);
=0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀,根据Al3++3OH-═Al(OH)3↓计算n(NaOH);
另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,溶液中溶质为NaCl、NaAlO2,根据铝原子守恒计算n(NaAlO2),再由钠离子守恒可知n(NaOH)=n(NaCl)+n(NaAlO2),根据氯离子守恒n(NaCl)=3n(AlCl3),以此解答.
解答:解:(1)氯化铝溶液加NaOH溶液,先发生Al3++3OH-=Al(OH)3↓,碱过量时发生Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O;
(2)现AlCl3的物质的量为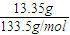 =0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
=0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
n(Al(OH)3)=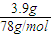 =0.05mol,
=0.05mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.05mol×3=0.15mol,
故NaOH溶液物质的量浓度为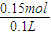 =1.5mol/L,
=1.5mol/L,
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,溶液中溶质为NaCl、NaAlO2,
根据铝原子守恒n(NaAlO2)=0.1mol-0.05mol=0.05mol,
由钠离子守恒可知n(NaOH)=n(NaCl)+n(NaAlO2),根据氯离子守恒n(NaCl)=3n(AlCl3),故n(NaOH)=n(NaCl)+n(NaAlO2)=0.1mol×3+0.05mol=0.35mol,故NaOH溶液物质的量浓度为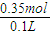 =3.5mol/L,
=3.5mol/L,
答:NaOH溶液物质的量浓度为1.5mol/L或3.5mol/L.
点评:本题考查铝元素化合物性质、化学计算等,题目难度中等,明确碱的物质的量对发生的化学反应的影响,根据沉淀的质量判断发生的反应是关键,注意利用守恒思想进行的解答.
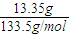 =0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀,根据Al3++3OH-═Al(OH)3↓计算n(NaOH);
=0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀,根据Al3++3OH-═Al(OH)3↓计算n(NaOH);另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,溶液中溶质为NaCl、NaAlO2,根据铝原子守恒计算n(NaAlO2),再由钠离子守恒可知n(NaOH)=n(NaCl)+n(NaAlO2),根据氯离子守恒n(NaCl)=3n(AlCl3),以此解答.
解答:解:(1)氯化铝溶液加NaOH溶液,先发生Al3++3OH-=Al(OH)3↓,碱过量时发生Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O;
(2)现AlCl3的物质的量为
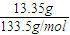 =0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
=0.1mol,完全生成Al(OH)3沉淀时,沉淀质量应为7.8g,现沉淀质量为3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,n(Al(OH)3)=
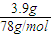 =0.05mol,
=0.05mol,①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.05mol×3=0.15mol,
故NaOH溶液物质的量浓度为
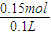 =1.5mol/L,
=1.5mol/L,②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,溶液中溶质为NaCl、NaAlO2,
根据铝原子守恒n(NaAlO2)=0.1mol-0.05mol=0.05mol,
由钠离子守恒可知n(NaOH)=n(NaCl)+n(NaAlO2),根据氯离子守恒n(NaCl)=3n(AlCl3),故n(NaOH)=n(NaCl)+n(NaAlO2)=0.1mol×3+0.05mol=0.35mol,故NaOH溶液物质的量浓度为
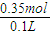 =3.5mol/L,
=3.5mol/L,答:NaOH溶液物质的量浓度为1.5mol/L或3.5mol/L.
点评:本题考查铝元素化合物性质、化学计算等,题目难度中等,明确碱的物质的量对发生的化学反应的影响,根据沉淀的质量判断发生的反应是关键,注意利用守恒思想进行的解答.

练习册系列答案
相关题目