题目内容
在以下变化中,需加入还原剂才能发生的是( )A.Cl- ![]() Cl2 B.
Cl2 B.![]()
![]() BaSO4
BaSO4
C.H2O![]() H2 D.
H2 D.![]()
![]() Mn2+
Mn2+
解析:碰到此类题型,一般主要可能出现两方面的判断误区,一是对于加入还原剂后物质发生的反应判断失误,认为是物质被氧化了,二是忽视了物质尽管发生了还原反应,但其本身就可作为还原剂,而不需要加入还原剂。
氧化还原过程中总有化合价的升降,化合价升高发生氧化反应,加入氧化剂;化合价降低,发生还原反应,加入还原剂。A中化合价升高,需加入氧化剂,B中未发生氧化还原反应,C中发生的是还原反应,但水本身可作为还原剂,不需要加入还原剂,D中Mn的化合价由+7变成+2化合价降低,必须加入还原剂。
答案:D

练习册系列答案
相关题目

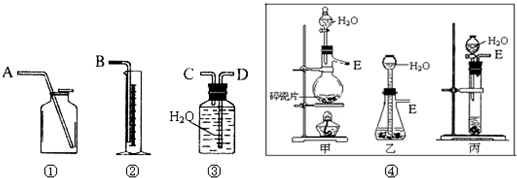
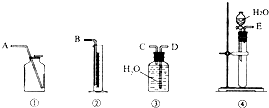 现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白:
现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白: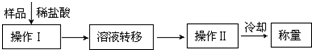
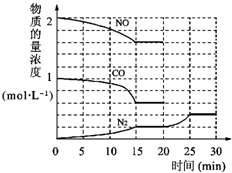 环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素. O2+Hb?CO
O2+Hb?CO N2(g)+2CO2(g)△H=-113kJ?mol-1
N2(g)+2CO2(g)△H=-113kJ?mol-1 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表: