题目内容
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表, 水解方程式ClOˉ+ H2O HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
C
【解析】
试题分析:A、根据生成NaF所对应的酸为HF,生成NaClO所对应的酸为HClO,生成Na2CO3所对应的酸为HCO3-,生成NaHCO3所对应的酸为H2CO3,酸性:HCO3-<HClO <H2CO3<HF,所以,三种酸溶液的导电能力顺序:HClO<H2CO3<HF,错误;B、0.1 mol·L-1Na2CO3溶液中,c(Na+) = 0.2 mol·L-1,将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,此时CO2过量,反应生成了NaHCO3 ,此时,溶液的体称没有变,溶液中的钠离子的浓度仍然为:c(Na+) =0.2 mol·L-1,根据电荷守恒有:c(Na+) + c(H+) = c (HCO3ˉ) + 2 c (CO32-) + c(OHˉ),由于溶液呈中性:c(H+) = c(OHˉ),则c(Na+) = 2 c (CO32ˉ)+ c (HCO3ˉ)= 0.2mol·L-1,错误;C、根据水解方程式:ClOˉ+ H2O HClO + OHˉ,水解的平衡常数表为;
HClO + OHˉ,水解的平衡常数表为;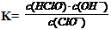 ?? 从上表可知常温下浓度为0.1 mol·L-1 NaClO溶液的pH=9.7,则pOH=4.3,c(OHˉ) = 10-4.3,所以,
?? 从上表可知常温下浓度为0.1 mol·L-1 NaClO溶液的pH=9.7,则pOH=4.3,c(OHˉ) = 10-4.3,所以,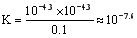 ,正确;D、向NaClO 溶液中通HF气体至恰好完全反应时,此时NaClO + HF = NaF + HClO,溶液中生成等物质的量的NaF和HClO,由于HClO为弱酸,不完全电离,存在着电离平衡:HClO
,正确;D、向NaClO 溶液中通HF气体至恰好完全反应时,此时NaClO + HF = NaF + HClO,溶液中生成等物质的量的NaF和HClO,由于HClO为弱酸,不完全电离,存在着电离平衡:HClO H+ + ClOˉ,同时,溶液中也还存在着NaF的水解平衡,但是终究水解程度是很微弱的,所以溶液中应该是c(Na+)>c(Fˉ) >c(HClO)>c(H+>c(OHˉ),故D不正确。
H+ + ClOˉ,同时,溶液中也还存在着NaF的水解平衡,但是终究水解程度是很微弱的,所以溶液中应该是c(Na+)>c(Fˉ) >c(HClO)>c(H+>c(OHˉ),故D不正确。
考点:电解质溶液,粒子浓度大小比较

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 H++A2- ,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:( )
H++A2- ,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:( ) H++A2-,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:( )
H++A2-,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:( )