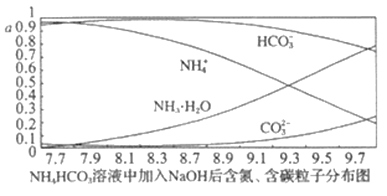
题目内容
【题目】光气(COC12熔点为-118℃,沸点为8.2℃,微溶于水,易溶于甲苯等有机溶剂)可作为化学武器的成分,其制备实验装置如图所示(夹持装置已省略)。
已知:3CCl4+2H2SO4(浓)![]() 3COCl2↑+4HCl+S2O5Cl2。下列说法正确的是
3COCl2↑+4HCl+S2O5Cl2。下列说法正确的是
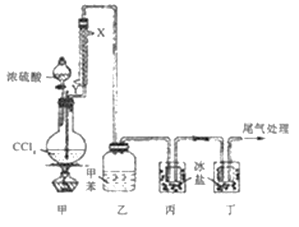
A. 装置组装连接后,第一步操作通入冷凝水,然后才能加热
B. 自来水从冷凝管的X口通入,且被冷凝的物质是CCl4
C. 装置乙中可收集到光气的甲苯溶液,装置丙、丁均可收集到液态光气
D. 可将装置丁的尾气通过导管直接通入NaOH溶液中进行尾气处理
【答案】C
【解析】
A、根据反应方程式,有气体生成,因此第一步操作是检验装置的气密性,故A错误;
B、冷凝水应从下口通入,上口出水,即从Y口进水,X口出水,被冷凝的物质是COCl2,故B错误;
C、光气易溶于甲苯,因此挥发出的光气被甲苯吸收,得到光气的甲苯溶液,根据光气的物理性质,装置丙、丁均可收集到液态光气,故C正确;
D、尾气中含有HCl,导管直接通入NaOH溶液,引起倒吸,应用倒扣的漏斗,故D错误。

 阅读快车系列答案
阅读快车系列答案【题目】甲烷是一种理想的洁净燃料,利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
(1)800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如表。则此时正、逆反应速率的关系是____。
CH4 | H2O | CO | H2 |
3.0molL-1 | 8.5molL-1 | 2.0molL-1 | 2.0molL-1 |
(2)为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ molL1 | H2O初始浓度/ molL1 |
1 | 360 | p | 2.00 | 6.80 |
2 | t | 101 | 2.00 | 6.80 |
3 | 360 | 101 | 2.00 | 6.80 |
表中t=____,P=_____;设计实验2、3的目的是________________;
实验l、2、3中反应的化学平衡常数的大小关系是____(用K1、K2、K3表示)。
(3)一定温度下,在容积2L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCH4、1molH2O | a molCH4、a molH2O、b molCO、c molH2 |
经测定甲容器经过5min达到平衡,平衡后甲中气体的压强为开始的1.2倍,甲容器中该反应在5min内的平均速率υ(H2)=_______,若要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则b的取值范围为________。