题目内容
下图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是( )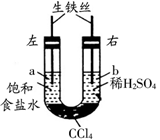
| A.铁丝在两处的腐蚀速率:a < b |
| B.a、b两处相同的电极反应式为Fe - 2e- = Fe2+ |
| C.一段时间后,a处液面高于b处液面 |
| D.生铁丝中的碳在a、b两处分别作原电池的负极和正极 |
D
解析试题分析:左、右两端都会发生原电池反应,但右侧电解质溶液中H+浓度大,反应速率快,A正确;左侧a中发生的是铁的吸氧腐蚀,Fe作负极,电极反应式为Fe - 2e- = Fe2+,右侧b处发生的是Fe的析氢腐蚀,Fe作负极,电极反应式为Fe - 2e- = Fe2+,B正确;一段时间后,b处生成氢气,压强增大,a处吸收氧气,压强减小,因此液面左高右低,C正确;在a、b两处的电池反应中,Fe都作负极,碳都作正极,D错。
考点:考查原电池,金属腐蚀。

练习册系列答案
相关题目
用如图所示装置进行实验,下列叙述不正确的是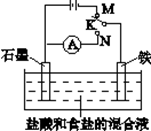
| A.K与N连接时,铁被腐蚀 |
| B.K与N连接时,石墨电极产生气泡 |
| C.K与M连接时,一段时间后溶液的pH增大 |
| D.K与M连接时,石墨电极反应:4OH——4e—==2H2O+O2↑ |
科学家们在研制一种吸气式的锂一空气电池,工作时吸收空气中的氧气在多孔金制成正极表面上反应。总反应可表示为2Li+O2 Li2O2,下列有关说法正确的是
Li2O2,下列有关说法正确的是
| A.充电时,多孔金制成的电极外接电源负极 |
| B.放电时,吸收空气中22.4L的O2,就有2mole-从电池负极流出 |
| C.放电时,Li+从负极向正极移动 |
| D.该电池可使用含Li+的水溶液作电解质溶液 |
用Pt做电极,电解含C(Cu2+): C(Na+): C(Cl-)=1:2:4的混合溶液,在任何情况下,阴、阳两极下不可能同时发生的反应是
| A.阴极:2H++2e-=H2↑阳极:4OH-- 4e-=2H2O+O2↑ |
| B.阴极:2H++2e-=H2↑阳极:2Cl--2e-=Cl2↑ |
| C.阴极:Cu2++2e-=Cu阳极:4OH-- 4e-=2H2O+O2↑ |
| D.阴极:Cu2++2e-=Cu阳极:2Cl--2e-=Cl2↑ |
有关下图电化学装置的叙述中,正确的是
| A.若X为碳棒,Y为饱和食盐水,K置于N,则铁极上析出氯气 |
| B.若X为铂棒,Y为CuCl2溶液,K置于N,则铁棒质量将增加 |
| C.若X为锌棒,Y为海水,K置于M,形成对铁的外加电流阴极保护 |
| D.若X为铜棒,Y为稀硫酸,K置于M,则正极反应为:Fe?2e→Fe2+ |
下列实验装置中,实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是 
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl— Cl2↑+H2↑ Cl2↑+H2↑ |
| B.断开K2,闭合K1时,电子沿“b →Cu→电解质溶液→石墨→a”的路径流动 |
| C.断开K2,闭合K1时,铜电极附近溶液变红 |
| D.断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl— |
用石墨作电极电解AgNO3溶液。通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的( )
| A.AgNO3 | B.H2O | C.Ag2O | D.Ag(NH3)2OH |
有关下列电化学装置的说法中正确的是
| A.图a是原电池装置,可以实现化学能转化为电能 |
| B.图b电解一段时间后,加入适量CuCO3固体,可以使硫酸铜溶液恢复到原浓度 |
| C.图c中的X极若为负极,则该装置可实现粗铜的精炼 |
| D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是
| A.A为电源正极 |
| B.阳极区溶液中发生的氧化还原反应为:Cr2O72- +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ + 7H2O |
| C.阴极区附近溶液pH降低 |
| D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O72-被还原 |