题目内容
下列各溶液中,微粒的物质的量浓度关系正确的是
c [(NH4)2SO4] < c [(NH4)2CO3] < c (NH4C1)
| A.0.1 mol /L的(NH4)2SO4溶液中:c (SO42-)> c (NH4+ )> c (H+)> c (OH-) |
| B.0.2 mol /L的Na2CO3溶液中:c (OH-)=c (HCO3-)+ c (H+)+ c (H2CO3) |
| C.0.1 mol /L的NH4Cl溶液与0.05 mol L-l的NaOH溶液等体积混合,其混合溶液中:c (Cl-) > c (NH4+ ) > c (Na+ ) > c (H+) > c (OH-) |
| D.c (NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4C1溶液中: |
D
根据化学式的书写可以确定若铵根离子不发生水解则铵根的浓度是硫酸根的2倍,由于水解是少量的所以浓度是c (NH4+ )>c (SO42-),A错误;碳酸钠溶液中的质子守恒的等式为c (OH-)=c (HCO3-)+ c (H+)+ 2c (H2CO3),碳酸分子中含有两个质子,B错误;氯化铵溶液与氢氧化钠溶液混合后溶液显碱性所以c (OH-)> c (H+) ,C错误;硫酸铵中含有两个铵根离子,且硫酸根离子对铵根水解没有影响,碳酸铵中含有两个铵根,但是碳酸根会促进铵根的水解所要使铵根离子的浓度相等碳酸铵的浓度应该大于硫酸铵,氯化铵中只有一个铵根,所以氯化铵的浓度最大,所以浓度大小顺序是c [(NH4)2SO4] < c [(NH4)2CO3] < c (NH4C1)
,答案选D。
,答案选D。

练习册系列答案
相关题目
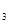 溶液时,往往在FeCl
溶液时,往往在FeCl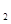 (SO
(SO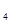 )
)